Состав и форма выпуска
ДЕЛЬТАРАН - синтетический нонапептид, структурно соответствующий
своему эндогенному аналогу. Дельтаран - смесь синтетического эндогенного
нонапептида, называемого дельта-сон индуцирующим пептидом, (1 весовая
часть) и аминокислоты глицина (10 весовых частей). Дельта-сон
индуцирующий пептид имеет следующую аминокислотную
последовательность: триптофанил-аланил-глицил-глицил-аспартил-аланил-
серил-глицил-глутаминовая кислота. Дельтаран выпускается в виде ампул с
лиофилизированным порошком или пористой массой белого цвета без запаха,
хорошо растворим в воде. В ампуле содержится 0,3 мг дельта-сон
индуцирующего пептида и 3мг глицина. Препарат предназначен для
интраназального применения.
ДЕЛЬТАРАН перед употреблением разводится кипячёной водой комнатной
температуры в количестве 1 мл, а затем закапывается по одной - две капли в
среднюю часть носа, в зону разветвления окончаний обонятельного нерва, как
известно, не имеющего синапсов на пути в ЦНС, с интервалом 10-20 минут.
После интраназального введения препарат достигает таламических ядер через
1,5-2 минуты. Стабилизирующий эффект развивается, в зависимости от уровня
эндогенных пептидов, в течение от 3 минут до 1,5 часов.
Фармакологические свойства
По спектру своей фармакологической активности пептид дельта-сна обладает
ярко выраженным стресс - протекторным и адаптивным действием (в
отечественной и зарубежной литературе уже имеются сотни публикаций на эту
тему) и перспективен для широкого медицинского применения не только в
наркологии, но и в неврологии, кардиологии, геронтологии, онкологии и в ряде
других областей медицины. Пептид дельта-сна как основной действующий
компонент Дельтарана является природным, вырабатываемым в организме
нейромодуляторным пептидом, обладающим широкой фармакологической
активностью. Благодаря своему сильно выраженному стресс - протективному и
адаптогенному действию этот пептид значительно увеличивает устойчивость
организма к воздействию различных неблагоприятных стрессовых факторов и
смягчает тяжесть патологических состояний вследствие заболеваний разной
этиологии. Пептид дельта-сна препятствует возникновению или ограничивает
выраженность стресс индуцированных патологических процессов в организме,
но в тоже время его модулирующее действие не проявляется при нормальном
физиологическом состоянии организма. Пептид дельта-сна обладает
антидепрессивным и противосудорожным действием, нормализует сон,
проявляет анальгетические и антитоксические свойства, повышает умственную
и физическую работоспособность, ограничивает вегетативные расстройства.
Пептид увеличивает резистентность организма к опухолевому росту и
уменьшает метастазирование. Этот нейропептид увеличивает электрическую
стабильность сердца и повышает порог фибрилляции, он ограничивает
кардиоваскулярные нарушения при стрессе. Пептид дельта-сна уменьшает
первичное патологическое влечение к алкоголю и наркотическим веществам,
купирует проявления алкогольной и опиатной абстиненции.
Фармакологическая стресс-протективная активность пептида дельта-сна
связана с его выраженной способностью ограничивать чрезмерное перекисное
окисление липидов мембран клеток мозга, крови, печени и др. органов,
накопление в них свободнорадикальных активных форм кислорода, уменьшая
тем самым серьезные нарушения в функционировании их регуляторных
мембранных систем. Пептид дельта-сна поддерживает баланс процессов
торможения и возбуждения в мозге и влияет на адаптивную синаптическую
пластичность мозга. Мишенью модуляторного действия пептида являются,
скорее всего, различные клеточные мембраны, в том числе - плазматические
мембраны нервных и других клеток (крови, печени, и. т. д.),
митохондриальные, лизосомальные и др. клеточные мембраны. Поддержание
нормальных структурных характеристик мембран клеток разного вида является
основой для их нормального физиологического состояния, удержания
регуляторных процессов в рамках их физиологических норм и предотвращения
их патологического срыва.
Страница 59

Теоретическое и практическое обоснование применения Дельтарана как
адаптивного и стресс-протективного препарата широкого действия.
Значительные успехи, достигнутые в последнее десятилетие в познании
механизмов регуляции физиологических процессов и гомеостаза стали основой
изыскания нового класса лекарственных средств, функционально и химически
близких к естественным эндогенным биорегуляторам. Разработка
лекарственных препаратов на основе природных биологически активных
пептидно-белковых молекул, занимающих важное место в регуляции основных
физиологических процессов организма, дополняет арсенал лекарственных
средств и значительно расширяет возможности медиков в лечении многих
заболеваний. Сегодня уже есть реальные возможности разработки на их основе
лекарств нового поколения, в частности, для коррекции функциональных
сдвигов в Центральной нервной системе, возникающих вследствие действия
экстремальных факторов внешней среды и при различных патологических
состояниях.
В ИБХ РАН в течение многих лет проводится химико-биологическое изучение
одного из регуляторных пептидов, а именно пептида дельта-сна. Его история
началась в 1977 году после сообщения швейцарских ученых М.Монье и Г.Шонненбергера
(1-2) о выделении гипногенного фактора пептидной природы
TrpAlaGlyGlyAspAlaSerGlyGlu из церебральной крови кроликов. Этот фактор
вызывал у кроликов увеличение представленности медленно-волнового сна в
электроэнцефалограмме после центрального или системного введения в малой
дозе, именно с этим связано его название - пептид дельта-сна (DSIP, delta sleep
inducing peptide).Сомнительность сомногенных свойств пептида и
разочарование в надеждах быстро получить на его основе снотворный
препарат, хотя и вызвало определенный скептицизм, тем не менее, явилось
стимулом для его более широкого изучения. Дальнейшие исследования(3)
выявили большой спектр психофармакологических свойств этого пептида,
который можно уверенно отнести к типичным нейромодуляторам,
проявляющим полифункциональное и пролонгированное действие на
организм.
В связи с отсутствием на момент середины восьмидесятых годов четких
представлений о биологической функции пептида дельта-сна ИБХ РАН
совместно с рядом медико-биологических учреждений был проведен большой
цикл исследований в направлении углубленного изучения биологических
свойств этого пептида.
В ходе этих исследований получены убедительные данные о том, что для
пептида дельта-сна наиболее выражена адаптогенная и стресс-протективная
активность. Системное введение пептида в малых дозах вызывало
существенное улучшение различных физиологических и метаболических
показателей, нарушаемых под воздействием различных стрессорных факторов.
В одной из пионерских работ(4) в этой области было установленно, что пептид
очень эффективно повышал устойчивость и выживаемость животных и сводил
к минимуму кардиоваскулярные нарушения, вызываемые острым
эмоциональным стрессом. Далее были проведены исследования влияния
пептида дельта-сна на животных in vivo в условиях воздействия на организм
различных по природе и силе стрессовых факторов (таких как гипоксия и
гипероксия, гипокинезия и холод, экспериментальный инфаркт миокарда и
применение эпилептогенов, экспериментальный алкоголизм и наркомания,
инокуляция опухолевых клеток, метастазирующие опухоли и др.). Эти
исследования выявили5-10 уникальную способность пептида существенно
ограничивать или предотвращать вызываемые стрессовыми факторами
губительные метаболические сдвиги. Пептид проявлял себя как очень
эффективный стресс - нормализующий фактор, который способствовал
удержанию физиологических процессов в организме в пределах естественной
адаптации и препятствовал их патологическим срывам, приводящим к
разрушению жизненно важных систем (кардио - и нейропротективный эффект,
антиметастатическое и противосудорожное действие и др.).
В течение ряда лет в совместных работах 11-17 с биологами и медиками были
исследованы биохимические процессы, лежащие в основе антистрессорного и
адаптогенного действия пептида дельта-сна. Проведено изучение влияния
ДСИП на активность ГАМК-ергической системы, играющей важную роль в
развитии адаптации к стрессорным воздействиям. Установлено, что ДСИП
приводит к длительному повышению уровня ГАМК в мозге в целом и особенно
в синаптосомах, уменьшает содержание глутаминовой и аспарагиновой кислот,
влияя, таким образом, на баланс возбуждающих и тормозных
нейромедиаторных аминокислот. Показано воздействие пептида на активность
ферментов синтеза и деградации ГАМК. Особенно значительно влияние
пептида при стрессе, приводящее к нормализации уровня ГАМК и
предотвращающее истощение ГАМК-системы. В ходе изучения
чувствительных параметров постстрессорных изменений в тканях и крови с
использованием ряда физико-химических и биохимических методов
определения антиоксидантной и свободнорадикальной активности было
показано, что сам пептид дельта-сна не обладает прямой антиоксидантной
активностью. Но при этом он проявляет выраженное антиоксидантное
действие, существенно снижая концентрацию конечного продукта
перекисного окисления липидов малонового диальдегида (МДА) в тканях мозга
и на периферии и оказывает ингибирующее действие ДСИП на процесс
накопления свободных радикалов в гипоталамусе крыс при гипоксии. Показано
существование положительной корреляции между глубиной стрессорного
воздействия и концентрацией МДА в тканях. Установлено, что
антиоксидантное действие ДСИП является следствием его влияния на
первичные стресс индуцированные процессы и сопряжено с активацией
основных клеточных антиоксидантных ферментов в различных тканях.
Антиоксидантные свойства ДСИП и его способность повышать емкость
антиоксидантной системы организма являются составной частью механизма его
антистрессорного эффекта, поскольку, как известно, перекисное окисление
липидов является обязательной компонентой стресс-реакции в организме.
Выявлена также способность пептида модулировать активность большого
числа регуляторных мембрано-ассоциированных и мембранных клеточных
ферментов.
Страница 60

Установлено долговременное и значительное влияние нейропептида на
активность протеолитических ферментов сыворотки крови и мозга крыс и
устойчивость лизосомальных мембран в условиях стресса. Это модулирующее
воздействие пептида было направлено на компенсацию стресс индуцированных
изменений и на предотвращение патологических деструктивных отклонений в
интенсивности протеолитических процессов, играющих важную роль в
метаболизме. С помощью электронной микроскопии на тонких срезах
сенсомоторной коры головного мозга крыс были получены данные о
регуляторном участии ДСИП в явлениях пластичности ЦНС. В зависимости от
физиологического статуса организма ДСИП оказывал различное регулирующее
влияние на активность возбуждающих и тормозных синапсов, результатом
которого являлась защита от повреждающего воздействия стрессовых факторов
или создание состояния неспецифической преадаптации, которое характерно
для начальных этапов стресса. Это состояние характеризовалось
соответствующими морфометрическими изменениями аксосоматических и
аксошипиковых синапсов, приводившими к ограничению патологических
сдвигов в балансе их тормозной и возбуждающей активности.
Инициирование пептидом дельта-сна адаптивных синаптических механизмов
проявлялось не только в ультраструктурных изменениях, но и в ряде
выявленных метаболических сдвигах, имеющих отношение к процессам,
протекающим в нейрональных мембранах при синаптической трансмиссии.
Полученные в ходе проведенных исследований данные позволяют полагать, что
модуляторное действие пептида связано с молекулярными механизмами
синаптической пластичности.
Проведенные исследования биологической активности ДСИП и механизма его
действия стали основой понимания широты фармакологического потенциала
пептида и перспективности его применения в медицине. Проведенные
официальные клинические испытания Дельтарана в наркологии, так и целый
ряд выполненных пилотных клинических исследований Дельтарана в других
областях медицины свидетельствуют о наличии реальных предпосылок для его
широкого медицинского использования.
Так, Дельтаран проявил себя как эффективное средство в онкологической
практике. Препарат, благодаря своему антиметастатическому и
антитоксическому действию значительно улучшал переносимость больными
курсов химиотерапии, повышал ее эффективность и снижал выраженность
токсических поражений.
Препарат позволял сократить крайне опасный период цитопении после
высокодозной химиотерапии у онкологических больных (детей и взрослых).
В качестве примера приводим следующее исследование:
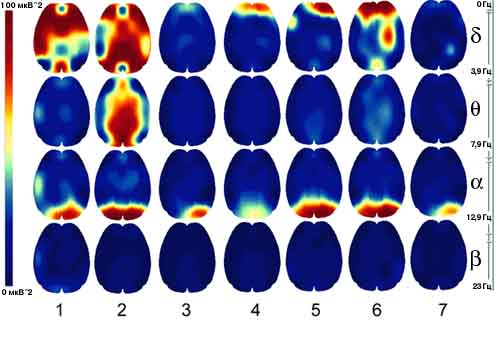
"Карты биоэлектрической активности головного мозга больного ребенка
(диагноз: Cаркома Юинга в/ 3 правой бедренной кости) в
процессе курса высокодозной химиотерапии".
(Исследование выполнено нейрофизиологом Синюхиным А.Б., ИЦ "КОМКОН")
1-ое исследование - распределение активности по конвекситальной
поверхности до начала химиотерапии.
2-ое - в течении куса химиотерапии
3-е -после курса химиотерапии на фоне развившейся цитопении
4-ое - перед следующим курсом химиотерапии после курса Дельтарана
5-ое - следующий курс химиотерапии
6 -ое - после курса химиотерапии на фоне цитопении
7 -ое - после выхода из цитопении
Страница 61

Первое исследование выявило преобладание медленноволновой активности
(дельта- и тета-) в диапазоне 0-4 кол/ сек, доля которой увеличивается на фоне
химиотерапии (2-ое исследование).
Сочетанное с химиотерапией введение Дельтарана приводит к стойкому
снижению медленноволновой активности с одновременной стабилизацией
альфа-ритма. Т.о. , представленные исследования наглядно иллюстрирует
положительное действие препарата Дельтаран по нормализации ритмики
головного мозга на фоне применения высокодозной химиотерапии.
На первом этапе препарат использовался в трех хосписах, у пациентов в
терминальной фазе заболевания. Оценка влияния препарата на общее состояние
30 пациентов показала улучшение общего состояния и снижение потребности в
наркотических анальгетиках у 2/3 больных. Результаты данной клинической
апробации позволили провести оценку эффективности применения Дельтарана
у 312 больных со злокачественными новообразованиями различных
локализаций, III-IV стадий, подвергавшихся химиотерапии и оперативному
лечению. Было показано, что применение Дельтарана не сопровождалось
нежелательными побочными эффектами, улучшало переносимость наркоза и
укорачивало сроки выхода из него, существенно улучшало послеоперационное
течение и общее состояние больных, существенно облегчало состояние
больных в процессе химиотерапии. Положительные результаты были получены
также и при изучении возможности применения Дельтарана у детей (83 чел.),
подвергающихся интенсивной полихимиотерапии по поводу новообразований
различного гистологического типа и локализации (18). Данные, полученные
при клиническом изучении Дельтарана у взрослых и детей, больных
онкологическими заболеваниями, свидетельствуют о его несомненной
эффективности в плане сокращения длительности постцитостатической
цитопении. Этот эффект Дельтарана позволил значительно сократить период
лейкопении и снизить частоту инфекционных осложнений.
В качестве другого примера можно привести данные клинического
тестирования Дельтарана на больных с дисрегуляторной атеросклеротической
энцефалопатией.(Таблицы 1,2).
Таблица 1. Динамика нейрологических синдромов
| Синдром |
1 группа (30 чел.) Вазоактивная терапия |
11 группа (30 чел.) Вазоактивная терапия + Дельтаран |
| Частота встречаемости |
Средний балл выраженности |
Частота встречаемости |
Средний балл выраженности |
| До лече ния |
После лече ния |
До лечения |
После лече ния |
До лече ния |
После лече ния |
До лече ния |
После лече ния |
| Цефалгический |
28 |
26 |
1.85 |
0.87 |
25 |
13 |
1.78 |
0.57 |
| Кохлеарный |
24 |
20 |
1.60 |
1.17 |
25 |
23 |
1.41 |
0.62 |
| Вестибулярно-атактический |
29 |
23 |
1.60 |
0.96 |
29 |
24 |
1.73 |
0.59 |
| Диссомнический |
22 |
19 |
1.56 |
1.07 |
30 |
6 |
1.20 |
0.28 |
| Амиостатический |
14 |
14 |
0.84 |
0.56 |
13 |
13 |
1.47 |
1.23 |
| Эмоционально-волевые нарушения |
26 |
26 |
1.58 |
1.54 |
30 |
25 |
2.12 |
1.08 |
| p<0.05 Статистическая обработка материала проводилась с помощью методов одномерной статистики в программах STADIA и MEDST. Поиск связей между признаками проводился по методу сопряженных таблиц. |
Таблица 2. Динамика нейропсихологических показателей
| Тип нарушений |
1 группа (30 чел.) Вазоактивная терапия |
11 группа (30 чел.) Вазоактивная терапия + Дельтаран |
| Частота встречаемости |
Средний балл выраженности |
Частота встречаемости |
Средний балл выраженности |
| До лече ния |
После лече ния |
До лече ния |
После лече ния |
До лече ния |
После лече ния |
До лече ния |
После лече ния |
| Нейродинамичес кие |
29 |
25 |
2.21 |
1.67 |
26 |
14 |
2.13 |
0.84 |
| Оптикопространст венные |
20 |
19 |
1.67 |
1.42 |
23 |
19 |
2.15 |
1.25 |
| Праксиса |
17 |
16 |
1.50 |
1.36 |
25 |
19 |
2.02 |
1.07 |
| Слухового гнозиса |
18 |
17 |
1.64 |
1.58 |
25 |
25 |
2.11 |
1.78 |
| Снижение слуховой памяти |
19 |
17 |
1.69 |
1.44 |
22 |
18 |
2.23 |
1.26 |
| Трудности абстрагирования |
22 |
22 |
1.65 |
1.63 |
19 |
18 |
1.58 |
1.36 |
| p<0.05 Статистическая обработка материала проводилась с помощью методов одномерной статистики в программах STADIA и MEDST. Поиск связей между признаками проводился по методу сопряженных таблиц. |
Препарат значительно подавлял интенсивность выраженности
нейрологических и психофизических синдромов как в условиях сочетания с
классической вазоактивной терапией, так и при монотерапии. Сделан вывод о
высокой эффективности Дельтарана при различных клинических проявлениях
дисрегуляторной энцефалопатии. Получены также положительные результаты
при клиническом апробировании препарата на военнослужащих для коррекции
функционального состояния, повышения устойчивости и улучшения адаптации
организма при действии экстремальных факторов и тяжелых условий труда.
Приведенные выше сведения о клинической эффективности Дельтарана далеко
не исчерпывают терапевтические и профилактические возможности этого
уникального и совершенно безопасного препарата нейропротективного
действия.
История создания препарата Дельтаран
Страница 62

В течение 1988-1998г. Институтом биоорганической химии им.Шемякина -
Овчинникова Российской Академии Наук (ИБХ РАН) совместно с НИИ
фармакологии РАМН проводилась работа по созданию лекарственного
препарата "Дельтаран" на основе эндогенного биорегуляторного пептида
(известного как пептид дельта-сна или дельта-сон индуцирующий пептид,
ДСИП) в качестве антиалкогольного средства. Дельтаран - это оригинальный,
не имеющий аналогов в мире лекарственный препарат, разработанный на
основе синтетического нонапептида ДСИП.
В 1990 году получено разрешение Фармакологического Комитета СССР на
проведение клинических испытаний Дельтарана на основе предварительно
выполненных доклинических испытаний безопасности препарата и изучения
его специфической биологической активности.
Клинические испытания проводились в наркологических клиниках Москвы и
Томска. По результатам проведенных клинических испытаний препарат был
рекомендован для применения в наркологической практике в качестве средства
для купирования алкогольного абстинентного синдрома при наличии
вегетативных и аффективных проявлений (субдепрессивных и дисфорических).
Клинические испытания показали, что Дельтаран проявляет
вегетостабилизирующее и нормотимолептическое действие, оказывающее
ингибирующее влияние на актуализацию первичного патологического влечения
к этанолу. Использовался метод двойного слепого контроля. Наибольшая
эффективность Дельтарана при купировании влечения к алкоголю проявилась у
больных, в структуру влечения которых входили аффективные нарушения в
виде субдепрессивных проявлений. Выявлено положительное воздействие
Дельтарана на отдельные проявления алкогольного абстинентного синдрома в
виде аффективных нарушений с подавленностью, чувством усталости и
астении, а также нормализующее влияние на сон больных.
В 1996г. было получено разрешение Фармакологического Комитета России на
применение препарата Дельтаран в медицинской практике для подавления
первичного патологического влечения к алкоголю. Какие-либо
противопоказания и побочные эффекты препарата не установлены.
Дельтаран разрешен к применению в медицинской практике в виде
лиофилизированного порошка. Способ введения - интраназальный.
В 1998г. созданные в ИБХ РАН проекты ВФС были одобрены Фармакопейным
Государственным Комитетом, а препарат Дельтаран лиофилизированный
зарегистрирован в Российской Федерации и разрешен для медицинского
применения приказом Министерства Здравоохранения РФ (П-8-242 ©
98/207/6).
Производителем Дельтарана является ООО "Исследовательский Центр
Комкон".
Страница 63

1. Schoenenberg G. A., Monnier M. // Proc. Natl. Acad. Sci. USA.1977.V.74 P.
1282-1286
2. Graf M. V., Kastin A. J. // Neurosci Biobehav Rev 1984 V 8 P. 83-93
3. Graf M. V., Kastin A. J. // Peptides. 1986. V. 7. P. 1165-1187.
4. Sudakov K. V., Ivanov V. T., Koplik E. V., Vedjaev D. F., Michaleva I. I.,
Sargsjan A. S/ Pavlov J Biol Sci 1983, 18:1 1-5.
5. Меерсон Ф. З., Сухих Г. Т., Фукс Б. Б., И. И. Михалева, Свиряев В. И. ДАН
СССР, 1984 Т. 274, ©2, c. 482-484.
6. Ульянинский Л. С., Иванова В. Т., Михалева И. И.// Космическая биология и
авиакосмическая медицина. 1990, ©3 С. 23-28.
7. Менджерицкий А. М., Ускова Н. И., Чароян И. О., Михалева И. И.//
Нейрохимия. 1990, Т. 9, ©2, c. 253-258.
8. Крыжановский Г. Н., Шандра А. А., Годлевский Л. С., Карпова М. Н.,
Михалева И. И.// Бюлл эксп. биол. мед.//1987 Т 104, ©11 С. 582-585.
9. И. А. Прудченко, Л. В. Сташевская, И. И. Михалева, В. Т. Иванов, А. А.
Шандра, Л. С. Годлевский, А. М. Мазарати. Биоорган. хим. //1993,т. 19,
©1,с. 43-55.
10. И. А. Прудченко, Сташевская Л. В., Шепель Е. Н., Михалева И. И., Иванов
В. Т., Шмалько Ю. П., Чалый А. П., Уманский В. Ю., Гринжевская С. Н. //
Биоорган. хим. //1993. Т. 19, 12, с. 1177-1190.
11. Шмалько Ю. П., Смирнов П. М., Михалева И. И., Чалый А. П., Уманский В.
Ю., Гринжевская С. Н.//Экспер. онкология//1993,Т. 15 ©1,с. 76-79.
12. Г. Т. Рихирева, М. Г. Маклецова, А. М. Менджерицкий, Л. С. Вартанян, С.
М. Гуревич, Е. Л. Лозовская, С. А. Копыловский, А. В. Рылова, И. И.
Михалева, И. А. Прудченко. Известия РАН, 1993,©2, 243-256.
13. Khvatova E. M., Rubanova N. A., Prudchenko I. A., Mikhaleva I. I.// FEBS
Letters 1995, 368, pp. 367-369.
14. Маклецова М. Г., Рихирева Г. Т., Менджерицкий А. М., Колесникова Л. В.,
Копыловский С. А., Михалева И. И.// Нейрохимия, 1995, Т. 12, вып. 3, с.
34-39.
15. Менджерицкий А. М., Лысенко А. В., Ускова Н. И. //Биохомия 1995 Т. 60
©4 с. 585-592.
16. Менджерицкий А. М., Михалева И. И., Мационис А. Э., Повилайтите П. Е//
Морфология 1994 Т. 106 © 4-6, с. 55-63.
17. Рихирева Г. Т., Голубев И. Н., Копыловский С. А., Прудченко И. А.,
Михалева И. И.//Биоорган. химия 1999, 25, ©5, с. 334-340.
18. Белогурова М.Б., Викторович Т.Д., Войтенков Б.О., Гавриленкова Л.П.,
Горошко Г.Н., Иванов В.Т., Михалева И.И., Прудченко И.П., Радулеску Г.Г.,
Чавпецова Э.Д., Владовская М.Д., Силков В.Б.
// Медицинская иммунология, 2000, Т.2,N2 c.211
Страница 64





 Articles
Articles