Санкт-Петербург, 2002 г.
РАЗДЕЛ 6. СПЕЦИАЛЬНЫЕ ФОРМЫ ТОКСИЧЕСКОГО ПРОЦЕССА
ГЛАВА 6.2.
Химический мутагенез
Мутации - это наследуемые изменения генетической информации, хранящейся в ДНК клеток. Различные факторы химической и физической природы способны вызывать мутации. Наиболее изученными являются последствия действия ионизирующей радиации и таких веществ, как сернистый и азотистый иприты, эпоксиды, этиленимин, метилсульфонат и т.д. Химические вещества, способные вызывать мутации называются мутагенами.
Далеко не всякая модификация молекулы ДНК (мутация) является опасной для организма. Более того, эволюция была бы не возможна без мутаций, поскольку именно она лежит в основе изменчивости. Опасность представляет случайный, ненаправленный мутагенез, как правило, несущий для организма негативные последствия. Неблагоприятные эффекты мутагенеза определяются тем, в клетках какого типа он реализуется: половых или соматических, стволовых и делящихся или созревающих и зрелых. Результатом грубых мутаций половых клеток и делящихся клеток развивающегося плода являются: стерильность особи, врожденная патология у потомства, тератогенез, гибель плода. Мутации стволовых и делящихся соматических клеток сопровождаются структурно-функциональными нарушениями тканей с непрерывной физиологической регенерацией (система крови, иммунная система, эпителиальные ткани) и канцерогенезом. Повреждение токсикантом ДНК зрелой соматической клетки не приводит к пагубным последствиям для организма.
Основными видами мутаций, вызываемых химическими веществами, являются: 1) точечная мутация, связанная с модификацией одного нуклеотида в структуре ДНК, (замещение нуклеотида, выпадение нуклеотида из цепи, включение дополнительного нуклеотида в цепь); 2) хромосомные аберрации, т.е. изменение структуры хромосом (разрывы молекул ДНК, транслокации фрагментов ДНК) или числа хромосом в клетке.
1. Точечные мутации
1.1. Замещение нуклеотида
Минимальным повреждением ДНК является замещение нуклеотида или нуклеотидной пары, называемое точечной мутацией. Если нуклеотид замещается на другой нуклеотид того же типа, например, пуриновое основание на пуриновое основание или пиримидиновое - на пиримидиновое, мутация называется транспозицией. Если пуриновое основание замещается пиримидиновым или наоборот, говорят о трансверсии. При действии химических веществ на организм точечная мутация происходит тремя способами: путем химической модификации нуклеотида, действием на нуклеотиды алкилирующих агентов, включением в цепь ДНК токсиканта - аналога азотистого основания.
Примером химической модификации является изменение нуклеотида азотистой кислотой.HNO2 способна превращать цитозин в урацил или аденин в гипоксантин (рисунок 1). Такой тип мутации выявлен в опытах с фагами, бактериями, микромицетами. У млекопитающих он возможен при действии активных в химическом отношении веществ, прежде всего на барьерные ткани (например, эпителий желудочно-кишечного тракта).
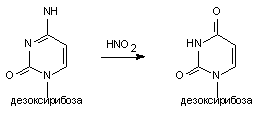
Рисунок 1. Превращение цитидина в уридин под влиянием азотистой кислоты
Алкилирующими агентами называются вещества, способные ковалентно присоединять алкильные радикалы к активным группам нуклеотидов ДНК. Такой способностью обладают сернистый и азотистый иприты, многие промышленные токсиканты, лекарственные (противоопухолевые) препараты (производные дихлорэтиламина: циклофосфамид, мелфалан; производные нитрозомочевины: кармустин, ломустин; алкилсульфонаты: бисульфан; цисплатин и т.д.) (рисунок 2).
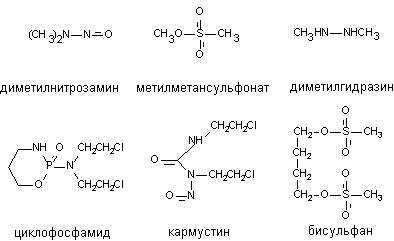
Рисунок 2. Структура некоторых алкилирующих агентов
К числу активных групп пуриновых и приримидиновых оснований, способных к алкилированию относятся азот в 1, 3, 7 положениях молекулы аденина; азот - в 3,7, и кислород в 6 положении молекулы гуанина; азот - в 3 и кислород - во 2 - цитозина; азот - 3 и кислород - 2 и 4 - тимина (рисунок 3). Помимо азотистых оснований алкилированию могут подвергаться фосфатные группы молекулы ДНК.
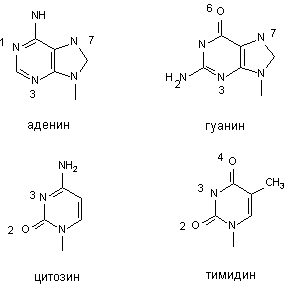
Рисунок 3. Участки наиболее вероятного алкилирования ДНК в физиологических условиях
Некоторые вещества, используемые в настоящее время в качестве противоопухолевых средств, являются структурными аналогами пуриновых и пиримидиновых оснований, входящих в ДНК. Поступая в организм, они включаются в синтез ДНК опухолевыми клетками, замещают генуинные нуклеотиды, вызывая летальные мутации. Результатом этого является гибель быстро делящихся клеток опухолей. К числу таких веществ относятся 5-бромурацил, 5-фтордезоксиуридин, 2-аминопурин, 6-меркаптопурин и т.д. Поражение этими веществами здоровых клеток организма, находящихся в фазе деления, может приводить к их мутациям (и пагубным последствиям для организма).
1.2. Выпадение или включение дополнительного нуклеотида
Выпадение или включение дополнительного нуклеотида в структуру ДНК кардинальным образом изменяет триплетный код, с помощью которого храниться информация о последовательности аминокислот в синтезируемом белке. Поскольку выпадение или включение основания приводит к "сдвигу" всей последовательности нуклеотидов (рисунок 4) последствия такой мутации, как правило, пагубны.
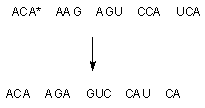
Рисунок 4. Выпадение аденина (А*) приводит к сдвигу цепи нуклеотидов влево и полному изменению триплетного кода
Некоторые токсиканты, например производные акридина, способны вызывать подобные изменения в структуре ДНК.
1.3. Репарация ДНК
Клетки обладают способностью корректировать и устранять повреждения ДНК. Вследствие этого лишь небольшое число мутаций, инициированных токсикантом, сохраняется в процессе репликации молекулы. Однако если мутация не распознана, извращенная информация транскрибируется в РНК, а затем экспрессируется в форме неполноценного протеина. Последствия этого для клетки могут быть либо несущественны, либо критичны, в зависимости от функций, выполняемых протеином.
Ряд ферментов, участвующих в репарации поврежденных ДНК, в настоящее время хорошо изучен (см. выше). Например, метилтрансферазы принимают участие в деметилировании О-6-метилгуанина. Гликозилазы расщепляют связи между азотом-9 пурина, подвергшегося алкилированию, образуя участки депуринизированной ДНК. Фрагменты нуклеиновой кислоты, состоящие, как правило, из 3 - 4 нуклеотидов, включая депуринизированный участок, вырезаются из цепи спомощью эндонуклеаз. В дальнейшем удаленные фрагменты заполняются при участии ферментов ДНК-полимераз и "встраиваются" в общую цепь с помощью ДНК-лигаз. Сбои в этом механизме могут приводить к повреждению генетического кода клеток.
2. Хромосомные аберрации
Для обозначения процессов, приводящих к делеции (выпадению), перестройке фрагментов хромосом или появлению дополнительных хромосом, которые выявляются с помощью световой микроскопии клеток, используют термин - кластогенез. Наиболее частой формой кластогенеза являются разрывы хромосом, которые вызываются, например, действием ионизирующего излучения и многих химических веществ. Алкилирующие агенты, особенно содержащие две функциональные группы в молекуле (сернистый, кислородный, азотистый иприты и их производные и аналоги, бисульфан, кармустин и т.д.), образуя поперечные связи с обеими цепочками молекулы ДНК, могут вызвать её разрыв. В основе разрыва лежит депуринизация поврежденных нуклеотидов соседствующих фрагментов обеих нитей ДНК, с последующим их одновременным вычленением с помощью эндонуклеаз (см. выше). Ферментом, принимающим участие в последующей репарации поврежденной ДНК, является поли-АДФ-рибозилполимераза. Аккумуляция в ядре клетки фрагментов ДНК активизирует энзим. Субстратом для образования АДФ-рибозилата, необходимого для восстановления целостности макромолекулы, является никатинамидадениндинуклеотид (НАД). Если ДНК повреждается значительно, на её репарацию расходуется большое количество НАД, что приводит к истощению запасов нуклеотида в клетке и острому энергетическому дефициту. Полагают, что этот феномен также может лежать в основе гибели клеток, подвергшихся действию мутагенов (например, иприта).
В ходе "сшивания" двунитевых разрывов хромосом весьма вероятны ошибки. Основные виды нарушений, возникающих при этом, это делеция, транслокация и инверсия частей хромосом.
Увеличение числа хромосом в клетке может явиться следствием нарушения процесса их разделения в ходе митоза между двумя дочерними клетками. В итоге образуются клетки с большим или меньшим числом хромосом. Иногда кратно увеличивается весь набор хромосом. Это явление называется - полиплоидия. Ряд химических веществ вызывают полиплоидию. К числу наиболее изученных относится колхицин (рисунок 5), связывающийся с мономерами тубулина, блокирующий его полимеризацию и за счет этого нарушающий образование митотических веретен.
Рисунок 5. Структура колхицина
Колхицин блокирует митоз в метафазе, вызывая полиплоидию поврежденной клетки. Другими примерами веществ, действующих подобным образом, являются производные алкалоида винкамина (винкристин, винбластин) и подофилотоксин. Полиплоидия у млекопитающих, как правило, является летальной мутацией (в отличии от растений).
3. Условия действия мутагенов на клетки
Все клетки организма находятся в одной из фаз клеточного цикла:
1. Покоя (фаза G0): клетка функционирует или покоится (большинство соматических неделящихся клеток);
2. Синтеза клеточных компонентов, необходимых для последующего синтеза ДНК (фаза G1): идет накопление необходимого количества пуриновых и пиримидиновых оснований и других химических компонентов ДНК. В делящейся клетке процесс занимает до 40% общего времени цикла клеточного деления;
3. Синтеза ДНК (фазаS): осуществляется "сборка" новой молекулы ДНК из наличествующих в клетке компонентов. Процесс занимает до 39% времени клеточного цикла.
4. Синтеза клеточных компонентов для митоза (фазаG2). В частности синтезируется мономеры и полимер тубулина и т.д. Процесс занимает около 19% времени цикла делящейся клетки.
5. Митоза (фазаM): разделение генетического материала между вновь образующимися дочерними клетками; клеточное деление. Процесс занимает 2% времени.
Часть химические вещества способны вызывать мутации лишь тех клеток, которые находятся в определенной фазе цикла, это так называемые цикло-специфичные вещества. Другие действуют на генетический аппарат не зависимо от того, в каком периоде клеточного цикла находится клетка (цикло-неспецифичные). Такая особенность в действии веществ определяется механизмом, посредством которого токсикант повреждает ДНК (см. выше). К числу цикло-неспецифичных принадлежат мутагены, способные вызывать химическое повреждение нуклеотидов (алкилирующие агенты и химические модификаторы нуклеотидов). Все остальные мутагены являются цикло-специфичными.
4. Изучение мутагенной активности
Изучение мутагенной активности химических веществ осуществляется в опытахin vitro на прокариотических и эукариотических клетках, путем непосредственного изучения степени повреждения ДНК, и выявления хромосомных аберраций у животных, подвергшихся действию токсикантов.
4.1. Исследования в опытах на прокариотах. Тест Эймса
В основе теста, разработанного Брюсом Эймсом, лежит способность мутагенов вызывать обратную мутацию измененного штаммаSalmonella typhimurium, неспособного к биосинтезу гистидина. Микроорганизмы данного штамма не растут в среде, не содержащей гистидин, однако под влиянием мутагенов вновь приобретают эту способность, свойственную исходному штамму сальмонелл (обратная мутация). В настоящее время созданы специальные штаммы, позволяющие выявлять мутации типа "замещение основания" (штамм ТА-1531) и типа "сдвиг цепи нуклеотдидов" (штамм ТА-1537, ТА-1538).
Тест осуществляется на суспензии бактериальных клеток в расплавленном при 450 агаре. В инкубационную среду (не содержащую гистидин) добавляют токсикант. К части проб добавляют также фракцию микросом, выделенных из гепатоцитов крыс, предварительно обработанных полихлорированными бифенилами, с целью индукции цитохромовР-450 (фракцияS-9). Смеси разливают по чашкам Петри. Число бактерий, приобретших вследствие обратной мутации способность синтезировать гистидин, оценивают путем подсчета колоний, развившихся в инкубате. Исследуемое вещество оценивается в нескольких концентрациях (установление дозовой зависимости эффекта). В итоге получается информация о наличии мутагенности у исходного вещества (среды без фракцииS-9) и его метаболитов (среды, содержащие фракциюS-9). Недостатком метода является сложность получения количественных характеристик мутагенной активности обследуемых веществ для млекопитающих и человека.
В настоящее время тестирование проводят и на других биологических объектах (прямая и обратная мутацияEscherichia coli,прямая мутация сальмонелл).
4.2. Исследования в опытах на клетках млекопитающих
Первоначально считалось, что культуры клеток млекопитающих будут идеальным объектом для изучения мутагенной активности токсикантов. Однако в процессе работы, вскрылись обстоятельства поколебавшие эти представления. Прежде всего клетки многих тканей трудно культивировать, у многих из них практически отсутствует способность к клонированию, метаболическая активность клеток недостаточна. В настоящее время в исследованиях предпочтение отдают культурам клеток перевиваемых линий (например, овариальные клетки китайского хомячка, клетки мышиной лимфомы и т.д.). Однако чувствительность этих клеток к ксенобиотикам уже отличается от чувствительности клеток первичных тканевых культур.
Исследования по оценке мутагенности обычно проводят, изучая изменения резистентности клеток к: 8-азагуанину или 6-тиогуанину (определяется активностью гипоксантин-гуанин-фосфорибозилтрансферазы - ГГФРТ); бромдезоксиуридину или трифтортимидину (определяется активностью тимидинкиназы - ТК); оуабаину (определяется активностьюNa/К-АТФазы).
ГГФРТ регулирует инкорпорацию пуринов из среды в клетку. Мутация локуса ДНК, ответственного за синтез энзима, приводит к угнетению ферментативной активности, прекращению транспорта пуринов в клетку, в том числе и их токсичных аналогов. Мутировавшие клетки выживают в среде, содержащей аза- и тиогуанины.
ТК активирует транспорт пиримидинов. Мутация лкуса ДНК, ответственного за синтез ТК, делает клетку не чувствительной к токсическому действию токсичных аналогов пиримидина.
Оуабаин убивает клетки, взаимодействуя сNa/К-АТФазой. Мутация локуса, ответственного за синтез этого энзима изменяет его сродство к токсиканту, увеличивает резистентность клетки к яду.
Наиболее часто используется модель мутации ТК локуса в опытах с культурой клеток мышиной лимфомы (иногда с добавлением в инкубационную средуS-9 фракции гепатоцитов). После воздействия исследуемого токсиканта оценивается количество клеток, способных образовывать колонии в среде, содержащей бромдезоксиуридин.
В настоящее время описано множество других тест-объектов, на которых можно проводить подобные исследования.
4.3. Оценка индукции синтеза ДНК клетками млекопитающих
Принцип метода заключается в оценке интенсивности репаративных процессов, инициируемых химическим повреждением ДНК. В основе метода лежит авторадиографическое определение степени инкорпорации меченного тритием тимидина в ядра клеток, предварительно обработанных обследуемым веществом.
Исследования обычно выполняются на гепатоцитах взрослых крыс самцов, диспергированных в инкубационной среде с последующей спонтанной адгезией на стеклянные подложки. В качестве положительного контроля используют гепатоциты, обработанные веществами, вызывающими повреждение ДНК и стимулирующими процесс её репарации: афлатоксином В1 или 2-ацетиламинофлюореном; отрицательные контроли - гепатоциты не подвергавшиеся воздействию. Перед исследованием клетки на определенное время помещают в среду, содержащую обследуемый токсикант. Выбор концентрации вещества осуществляется в ходе предварительных опытов, путем определения кривой зависимости "доза-эффект" по показателю жизнеспособность клеток (окраска обработанных веществом клеток трипановым синим). После воздействия клетки отмывают и помещают в среду, содержащую тимидин, меченый тритием. После инкубации их высушивают, фиксируют и покрывают эмульсией для авторадиографического исследования. Спустя определенный экспозиционный период (обычно несколько недель) производят подсчет числа оптически плотных гранул над областью ядра клеток, отражающих степень инкорпорации тимидина. Поскольку гепатоциты обладают высокой способностью к репарации, чем выше степень инкорпорации тимидина, тем большее повреждение ДНК вызвал исследуемый агент.
Недостатком метода является то, что с его помощью невозможно оценить, приводит ли процесс репарации к формированию ошибок генетического кода (формируются ли мутации), то есть решить, является ли инициированное повреждение ДНК пагубным для клетки.
4.4. Исследование ковалентного связывания токсикантов
Поскольку многие мутагены способны образовывать ковалентные связи с пуриновыми и пиримидиновыми основаниями молекул ДНК (аддукты ДНК), выявление аддуктов ДНК является прямым свидетельством генотоксичности ксенобиотика. Неинвазивные методы предполагают выявление аддуктов в моче животных, подвергшихсявоздействию токсикантов; инвазивные - выделение органов и тканей отравленных животных, экстракцию из гомогенатов тканей ДНК и нуклеотидов, с последующим их химическим (иммунохимическим) анализом.
4.5. Изучение хромосомных аберраций
Хромосомные аберрации, вызванные действием химических веществ, могут быть выявлены путем окрашивания клеток и последующего изучения с помощью обычного светового микроскопа. Для исследования могут использоваться культуры клеток (например, яичника китайского хомячка), обработанные изучаемым токсикантом по одной из схем, описанных выше, клетки костного мозга или лимфоциты периферической крови млекопитающих, которым токсикант вводилиin vivo. Виды выявляемых мутаций при этом включают: выпадение хроматидов, разрывы хромосом, делеции хромосом, появление хромосомных фрагментов, транслокации, полиплоидии.
Одним из широко используемых методов выявления генотоксичности является так называемый "микронуклеарный тест". Микроядра представляют собой фрагменты хромосом или целые хромосомы, не включенные в состав ядра, в ходе митотического деления клетки. Как правило, образование микроядер провоцируется веществами, вызывающими разрывы хромосом (кластогенные агенты) и токсикантами, повреждающими белки митотического веретена (см. выше). Токсиканты обычно вводят в дозах, составляющих 0,1 или 0,5 ЛД50. Контролем служит растворитель. У животных (как правило, мышей), подвергшихся действию химического вещества, после умерщвления, осуществляют забор косного мозга, окрашивают препарат и подвергают его микроскопии. Забор материала производят в течение определенного времени с интервалом 2 суток после прекращения (или на фоне продолжающегося) введения токсиканта. Количество клеток, содержащих микроядра, в препаратах костного мозга, полученных от животных разных групп, подсчитывают и сравнивают.
Повреждение герменативного эпителия (нарушения сперматогенеза) токсикантом может быть выявлено в опытах на крысах, мышах, хомячках. Самцам лабораторных животных изучаемый токсикант вводят в течение времени, необходимого для реализации полного цикла сперматогенеза, периодически (раз в неделю), спаривая их с самками разных групп. Самки умерщвляются спустя 2 недели после спаривания. Исследуются: состояние желтых тел яичников, соотношение живых и погибших эмбрионов. Конечными характеристиками оценки мутагенеза являются: индекс оплодотворяемости (отношение оплодотворенных самок к общему числу, спарившихся с самцами), преимплантационные потери (соотношение числа имплантировавшихся эмбрионов к числу желтых тел в яичниках),количество животных с мертвыми имплантатами относительно общего числа беременных самок, количество погибших имплантатов к общему количеству имплантатов.
Наследуемые мутации могут быть выявлены путем прямого исследования клеток потомства (на различных стадиях развития) самок или самцов, подвергшихся воздействию токсикантов.
Описание других, более сложных методов исследования, можно найти в специальной литературе.
<< Содержание |



 Федеральное государственное бюджетное учреждение науки
Федеральное государственное бюджетное учреждение науки