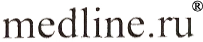Прогрессирующий рост травматизма в России в настоящее время приводит к увеличению хирургической активности при тяжелой черепно-мозговой травме. Частота ЧМТ в среднем составляет 4 случая на 1000 населения (около 600000 случаев в год), при этом среди причин инвалидизации, наступившей вследствие травм, на долю ЧМТ приходится 25-30% (Коновалов А.Н и соавт., 1998), из них значительную часть инвалидов составляют пациенты, имеющие трепанационные дефекты (40% по данным Н.Е.Мельника (1998) и Р.Д.Касумова (2003)) в связи с устоявшимся предпочтением декомпрессивной резекционной трепанации (путем "скусывания" костей черепа) при ЧМТ. При этом причинами снижения трудоспособности у пациентов с трепанационными дефектами являются неврологические и психические расстройства (в том числе и синдром трепанированных или "запавшего кожного лоскута" -"Sinking Skin Flap Syndrom"), которые часто не зависят от причины, приведшей к возникновению дефекта. При этом в неврологическом статусе отмечаются церебрально-очаговый, астенический синдром, вестибулярный, диэнцефальный синдромы и их сочетания, грубые изменения ЭЭГ и мозгового кровотока.
Медицинская реабилитация, по определению комитета экспертов ВОЗ (1980) - это активный процесс, целью которого является достижение полного восстановления нарушенных функций вследствие заболевания или травмы. Иными словами, цель реабилитации - предупреждение инвалидности в период лечения заболевания и в случае развития инвалидности оказание эффективной помощи больному в достижении максимально возможной физической, психической, профессиональной, социальной и экономической полноценности. Нейрореабилитация является одним из важных разделов медицинской реабилитации.
Оптимальным при проведении восстановительного лечения неврологических больных является устранение или полная компенсация повреждения. Таким образом, при наличии трепанационного дефекта у больных с последствиями тяжелой ЧМТ патогенетическую терапию следует начинать с его пластического закрытия.
В настоящее время наиболее используемыми биологическими методами закрытия трепанационных дефектов являются ауто- и аллопластика. Общепризнанным фактом является несомненное преимущество аутотрансплантатов над другими видами пластического материала. Это доказано в работе Э.Б.Бухабиба (1978) и неоднократно упоминается в трудах В.Ю.Зотова, Р.Д.Касумова и др. Однако при невозможности использовать для краниопластики собственную кость больного, удаленную с целью наружной декомпрессии и консервированную различными методами, приходится использовать алломатериал как наиболее перспективный в применении и снижающий инвалидизацию пациента за счет потенцирования процессов остеогенеза, его перестройки с трансформацией в собственную. Для успеха оперативного вмешательства по пластическому закрытию трепанационных дефектов важен выбор метода обработки, консервации и заготовки трансплантата, именно от этого зависят его антигенные, а также биопластические и остеоиндуктивные свойства. Считаем неприемлимым необоснованное использование эксплантатов, которые как всякий инертный материал, введенный в костную ткань, оказывают механическое, биологическое, химическое и физико-химическое действие на окружающие ткани, вызывая как септические осложнения, так и токсическое и даже канцерогенное действие на клетки (Ф.Турнер, 1936; В.Оппенгеймер, 1948; Имамалиев А.С., 1973; Грушинин Р.А., 1978; Зотов Ю.В., 1998; Кравчук А.Д., 2000; White.J.,1948; De La Camp,1959; White.J., 1970; Morrow J.D., 1994).
В настоящее время существует много способов консервации и хранения аллотрансплантатов. По способу консервации аллогенной костной ткани различают минерализованные (замороженные, формалинизированные, лиофилизированные, депротеинизированные) и деминерализованные трансплантаты, имеющие как преимущества, так и индивидуальные недостатки. Именно от способа консервации зависят трансплантационные качества ткани, поэтому поиск новых способов является одной из важнейших задач трансплантологии.
В практическом здравоохранении в настоящее время наиболее распространенным, простым и доступным методом консервации является метод консервации костной ткани в слабых растворах формалина (проф. В.Ф.Парфентьева и др., 1970), а также еe модификация (проф.В.И.Савельев и др., 1982). При краниопластике преимущества формалинизированной аллокости перед трансплантатами, консервированными другими методами (замораживание), отражены в работах Бухабиба Э.Б. (1978), Парфентьевой В.Ф. (1971), Абакарова А.А. (1975), Удодова А.Н. (1979), Баталова О.А. (1980). Однако формалинизированная кость содержит костный мозг, который является сильным антигеном, обуславливающим иммунную реакцию отторжения на пересаженный трансплантат, поэтому теоретически кость, обработанная и лишенная красного костного мозга должна обладать меньшими антигенными свойствами и обеспечивать наибольшую тканевую совместимость трансплантата.
Цель и задачи работы:
Улучшение ближайших и отдаленных результатов лечения больных с трепанационными дефектами черепа путем совершенствования способа подготовки костей черепа к пересадке и применения демиелинизированных аллотрансплантатов.
Учитывая вышесказанное, были поставлены задачи разработать новый способ подготовки аллотрансплантатов для улучшения их трансплантационных качеств, оценить эти качества в эксперименте и в клинике, произвести сравнительную оценку клинических результатов краниопластики аллотрансплантатами, консервированными по предложенной методике (демиелинизация) и методике, широко применяемой в настоящее время (в растворе формалина).
Методика:
Известно, что наибольшей иммуногенностью обладают в костях свода черепа протеогликаны костного матрикса и красный костный мозг. В соответствии с поставленными задачами нами предложен метод приготовления аллотрансплантатов для пластического закрытия дефектов костей свода черепа (приоритетная справка ?037308 от 24.12.01), который позволяет улучшить результаты их пересадки путем удаления жирового и миелоидного мозга в процессе специальной обработки. Фрагменты свода черепа, полученные через 4-6 часов от момента смерти донора, после удаления твердой мозговой оболочки и мягких тканей, подвергались механической обработке. С помощью электрической дрели и фрезы на наружной кортикальной пластинке, примерно в шахматном порядке, формируют овальные углубления (ямки), не проникающие через внутреннюю диплоэтическую пластинку. Средний диаметр таких ямок равняется 5 мм, а расстояние между ними составляет 7-10 мм. Готовили рабочую смесь, для чего к 100 мл 5% р-ра натрия хлорида добавляют 5 мл пергидроля. Полученную смесь перемешивали и использовали для заливки подготовленных препаратов, при этом следили, чтобы соотношение заготавливаемых трансплантатов к объему рабочей смеси было бы не менее чем 1:5.
Обработку препаратов вели при комнатной температуре (18?+ 5?С), меняя рабочую смесь через каждые два часа. Общее время обработки составляло 10-12 часов. После каждого цикла обработки, включающего 4-6 часов в день, препараты отмывали в дистиллированной воде при +5?...7?С в течении 18-24 часов. Контроль за окончанием процесса изготовления трансплантатов осуществляли визуально. После стерилизации газообразной окисью этилена и соответствующей упаковки они были использованы в клинической практике. (рисунок 1).

Рисунок 1
Внешний вид демиелинизированного трансплантата после обработки по предложенной методике
Обоснование эффективности применения собственной методики в эксперименте и в клинике.
Работа по оценке трансплантационных качеств демиелинизированных аллотрансплантатов состоит из экспериментальной и клинической части.
Экспериментальное обоснование применения собственной методики приготовления аллотрансплантатов производилось на базе ГУ РосНИИТО им. Р.Р.Вредена МЗ РФ в 3-х сериях опытов на 36 кроликах, изучались биопластические свойства минерализованных трансплантатов. Кроликам производились операции по пересадке трансплантатов лучевой кости. При выполнении экспериментального раздела работы применяли макроскопический, рентгенологический и гистологический методы исследования. В установленные сроки, т.е. через 30, 90, 180 и 360 суток животных под наркозом забивали воздушной эмболией. Затем иссекали кости предплечья с окружающими тканями. При макроскопическом исследовании обращали внимание на наличие воспалительных явлений в области пересадки, развитие рубцовой ткани, прочность сращения трансплантата с костным ложем, их структуру. Материал декальцинировали трилоном Б, проводили через спирты и заливали в целлоидин. Срезы окрашивали гематоксилином и эозином. Рентгенографию конечностей у экспериментальных животных производили в двух проекциях на аппарате УРДД при фокусном расстоянии 75 см без экрана, напряжении 55 кВт и выдержке 0.6 сек. Сравнивались рентгенологические и гистологические аспекты применения формалинизированных (1 и 2 серии) и демиелинизированных (3 серия) трансплантатов, которые показали более высокие показатели стимуляции остеогенеза, синхронности и скорости процессов рассасывания и замещения трансплантатов в опытной группе. Общие закономерности процессов перестройки по рентгенологическим данным сводились к следующему. На 15 сутки после операции возникала периостальная реакция со стороны концов резецируемой лучевой кости. К 30 дню концы последней утрачивали четкость контуров и становились несколько размытыми. (рисунок 2)
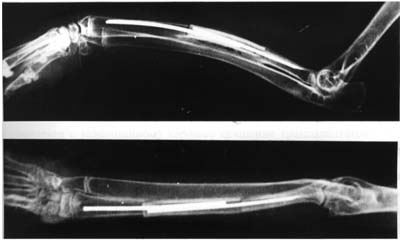 Рисунок 2.
Рисунок 2.
Рентгенограммы костей предплечья кролика через 30 суток после пересадки. Трансплантат приготовлен по предложенной методике.
Через 60-90 суток возникало довольно прочное сращение между концами трансплантата и лучевой кости. (рисунок 3).
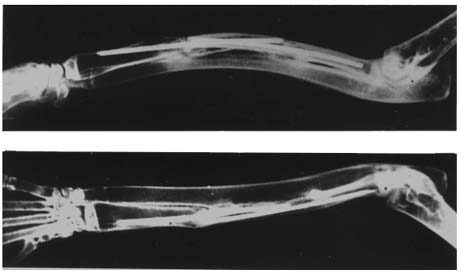
Рисунок 3.
Рентгенограммы костей предплечья кролика через 90 суток после пересадки. Трансплантат приготовлен по предложенной методике.
К этому времени начинали выявляться отчетливые признаки перестройки трансплантата, сначала в его концевых отделах, а затем и в кортикальной пластинке, прилежащей к соседнему участку лучевой кости. Спустя 120-180 суток перестройка носила активный характер и захватывала почти весь трансплантат за исключением его наружной кортикальной пластинки, которая к этому времени оставалась без видимых изменений. Между перестраивающейся внутренней кортикальной пластинкой трансплантата и истонченной кортикальной пластинкой соседней локтевой кости образовывались довольно выраженные сращения, которые со временем рассасывались, что приводило к появлению различных по величине и форме полостей, соединяющих костно-мозговые каналы новообразованной лучевой и локтевой костей (рисунок4).
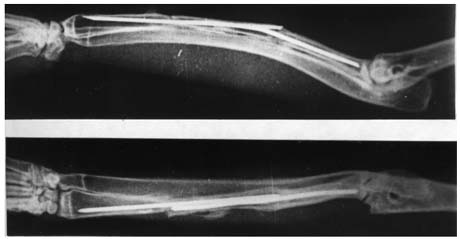
Рисунок 4.
Рентгенограммы костей предплечья кролика через 180 суток после пересадки. Трансплантат приготовлен по предложенной методике.
К концу 270-360 суток дефект лучевой кости был замещен новообразованной костной тканью, в массе которой еще были видны фрагменты старой кости (рисунок 5) .
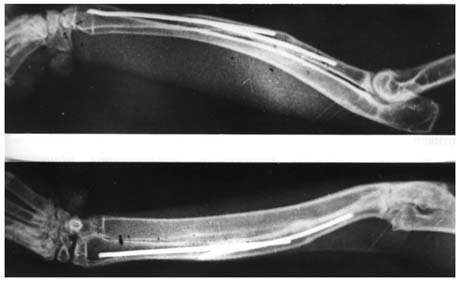
Рисунок 5.
Рентгенограммы костей предплечья кролика через 360 суток после пересадки. Трансплантат приготовлен по предложенной методике.
Особенно медленно рассасывалась и замещалась наружная кортикальная пластинка трансплантата. Другими словами, на рентгенограммах полной перестройки трансплантатов в течение первого года после пересадки мы не наблюдали у большинства оперированных животных. Биопластические свойства и результаты применения трансплантатов, несмотря на общие закономерности, отмеченные выше, оказались различными. По сравнению с контролем, стимуляция остеогенеза, синхронность и скорость процессов рассасывания и замещения трансплантатов, качество новообразованного костного регенерата наиболее интенсивно были выражены в третьей серии, где применялись аллотрансплантаты, приготовленные по предложенной методике. К концу года такие трансплантаты оказывались почти полностью перестроившимися. Процесс перестройки в динамике подтверждeн гистологически.
Клиническая часть включала изучение 123 больных, лечившихся в Российском научно-исследовательском нейрохирургическом институте имени проф. А.Л.Поленова в период с 1995 по 2003 гг. с последствиями травмы черепа и головного мозга и наличием дефектов костей черепа. Всем больным была произведена краниопластика. Пластическим материалом в исследуемых группах больных являлись аллокость, приготовленная по предлагаемой методике (демиелинизированные трансплантаты)(60 больных) и аллокость, консервированная в традиционно в формалине по методике, разработанной В.Ф.Парфентьевой в 1970г (63 больных). Тщательному анализу подвергнуты результаты пластических операций дефектов костей свода черепа различной локализации, величины и формы.
Исследуемая группа состояла на 91% из мужчин (113 больных) и на 9% из женщин (11 больных). Возраст оперируемых варьировал от 15 до 61 лет, средний их возраст составил 32.7 лет. Большинство больных (89.4%) относится к трудоспособному возрасту. Значительное количество больных до краниопластики имела инвалидность. Из них 19 больных имели инвалидность первой группы (15.4%), 35 больных (28.4%) имели вторую группу инвалидности, 4 больных (3.2%) - третью группу; 40 больных (32.5%) были трудоспособны, 7 больных (5.7%) относились к категории пенсионеры, дети. 18 больных (14.6%), находившихся на лечении в РНХИ в остром периоде имели продленный больничный лист.
9 больным в стационарах по месту жительства была произведена краниопластика эксплантатами (протакрил, бутакрил), однако неудовлетворительный косметический дефект (2 больных) или появление судорожных припадков (7 больных) служили причиной для обращения в РНХИ для их удаления и аллокраниопластики.
У 8-и больных (6.5%) в острый или отдаленный периоды после произведенного оперативного вмешательства по поводу ЧМТ осложнились воспалительными явлениями (вентрикулит, менингит, менингоэнцефалит, остеомиелит и т.д.), что в значительной мере повлияло на результаты произведенной поздней краниопластики.
Показания к краниопластике были лечебные, профилактические и косметические.
Большинству больных краниопластика производилась в отдаленном периоде. 123-м больным произведено 129 оперативных вмешательств (6-и больным производилось 2 операции по пластике трепанационных дефектов, из них 2-м - одномоментно закрыто 2 дефекта кости). Среднее количество суток от краниотомии до пластики равно 824 суток. Первичная краниопластика произведена 1 больному (0.8%), первично-отсроченная - 21 больному (16.3% ), поздняя - 107 (82.9%). Трeм больным для купирования гипертензионно-гидроцефального синдрома перед краниопластикой производились ликворошунтирующие операции. Трем больным из первой группы (пластика демиелинизированной костью) произведена комбинированная (ауто+аллокраниопластика).
Костные трансплантаты для контрольной группы (формалинизированную аллокость) заготавливали от трупов людей в возрасте от 16 до 50 лет, не позднее 12 часов после смерти. После забора в асептических условиях трансплантаты помещались в банку с 0.5% раствором формалина и хранились в бытовом холодильнике при температуре 2-4?С. Через 3 недели трансплантат погружали в 0.25% раствора формалина со сменой его не реже 1 раза в месяц.
Подготовка костных трансплантатов по предложенной методике осуществлялся в отделении консервации тканей ГУ РосНИИТО им. Р.Р.Вредена МЗ РФ. Перед операцией производилось комплексное обследование всех больных, включающее в себя клинико-неврологическое, рентгенологическое (в т.ч. КТ иили ЯМРТ), электроэнцефалографическое обследование специалистов смежных специальностей в динамике. исследовались также анализы ликвора, клинический и биохимический анализы крови. При исследовании психического и неврологического статусе патологии не выявлено у 5 больных, больные предъявляли жалобы только на наличие косметического дефекта, церебрально-очаговый синдром выявлен у 97 больных ( 78.86 %), астенический - у 78 больных ( 63.4 %), диэнцефальный - у 10 больных ( 8.1%) , вестибулярный - в 42 случаях ( 34.14 %) ; данные синдромы изолированно встречались лишь в 41 наблюдении (33.3%) (церебрально-очаговый у 24 больных, астенический - у 15 больных, вестибулярный у 2-х больных), у других больных отмечалось их сочетание (с наибольшей частотой встречалось сочетание церебрально-очагового и астенического синдромов (32 больных - 26%).
По данным КТ (ЯМРТ) у 53 больных при предоперационном обследовании выявлены рубцово-атрофические изменения головного мозга в области трепанационного дефекта, кисты обнаружены у 16 больных, посттравматическая гидроцефалия выявлена в 25 случаях (из них 3 -в стадии декомпенсации и требовала шунтирующей операции), инородные тела (металлические клипсы, фрагменты ранящих снарядов) обнаружены у 6 больных, отломки вдавленного перелома (в основном у больных, лечившихся в остром периоде)- у 7 больных, у 2-х больных выявлено смещение трансплантата после предыдущих операций. При краниографии площадь трепанационных дефектов варьировала от 9 до 300 см3, средний размер 58 см2. 6-и больным оперативное вмешательство производилось на трепанационных дефектах двусторонней локализации, наиболее частая локализация - теменно-височная (43 наблюдения - 35 %).
Предоперационная электроэнцефалография произведена 83 больным (36 больным из 1-й группы, 47- из 2-й группы). До операции у всех 83-х больных (100%) выявлялись изменения биоэлектрической активности.
Всем больным в до- и послеоперационном периоде проводились контрольные биохимический и клинический анализы крови, по которым проводилось изучение закономерностей изменения состава крови и проводилась сравнительная характеристика изменений в двух группах больных.
Краниопластика производилась под комбинированным эндотрахеальным наркозом в положении больного, при возможности (в зависимости от локализации), предпочтительно на боку. Этим достигалась физиологичность положения и возможность проведения "разгрузочной" люмбальной пункции. Кожный разрез в большинстве случаев проходил по старому рубцу с его экономным иссечением, отсепаровывался кожно-апоневротический лоскут, производился менинголиз и обнажались края дефекта. Девяти больным производилось удаление протакрилового трансплантата, двум - измененного аутотрансплантата, одному больному - отломков консолидированного вдавленного перелома с первичной краниопластикой (больной из 1-й группы) . При поздней краниопластике края дефекта экономно резецировались кусачками. Имеющиеся участки новообразованной костной ткани удаляли. Менингоэнцефалолиз производился при наличии эписиндрома в 15 случаях (12.2%), электрокортиграфия нами произведена в 10 случаях (8.1%). Дальнейшая тактика оперативного вмешательства определяется в зависимости от данных интраоперационного электрофизиологического исследования и состояния головного мозга. Так, вскрытие кисты с иссечением еe стенок произведено 6 больным, удаление инородных тел - металлических клипс - 3 больным, удаление коркового эпилептического очага - 3 больным, оболочечно-мозгового и мозгового рубца- в 4 наблюдениях. После тщательного гемостаза производилось герметичное ушивание твердой мозговой оболочки, при необходимости выполнялась еe пластика (лиофилизированной ТМО - 1 больному, собственной фасцией височной мышцы - в 3-х случаях). Затем, на стерильную металлическую фольгу контактным способом путем надавливания на неe по краю костного дефекта наносили форму и размеры имеющегося дефекта. По периметру всего вдавления фольгу обрезали ножницами и с помощью полученного трафарета величину и форму костного дефекта контактным способом переносят на кость донора с учетом локализации дефекта и величины необходимой должной сферичности трансплантата. Трансплантат выпиливали проволочной пилой, а для более точного моделирования трансплантата использовались кусачки. Трансплантат укладывался в дефект, в шести случаях ввиду незначительной протрузии головного мозга для профилактики вторичных нарушений при неэффективности анестезиологических мероприятий (гипервентиляция, введение диуретиков) производили разгрузочную люмбальную пункцию. Обязательным условием операции являлось плотное прилегание трансплантата к костному ложу реципиента по всей окружности (рисунок 6) При этом в девяти операциях больным 1-й группы соответствие поверхности трансплантата с конфигурацией черепа достигалось использованием бормашины. Трем больным производилась комбинированная краниопластика. В этих случаях трансплантат состоял из двух фрагментов (ауто- и алло-), соединенных между собой лигатурами (рисунок 7). Фиксацию трансплантатов осуществляли лигатурным способом, в четырех случаях - в сочетании с использованием клеевой композиции. В щели между трансплантатом и ложем реципиента укладывалась костная стружка, взятая из кортикального слоя прилегающей кости больного. Операцию заканчивали послойным ушиванием раны с оставлением дренажей, накладывалась асептическая давящая повязка.
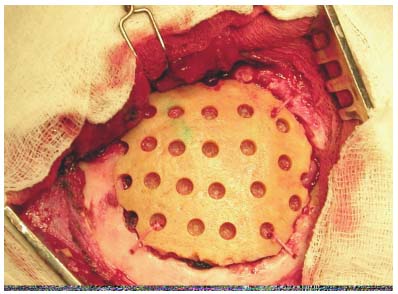
Рисунок 6.
Аллокраниопластика демиелинизированной костью.
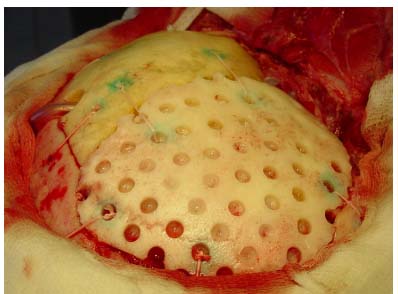
Рисунок 7.
Комбинированная (ауто-, алло) краниопластика
Больным в течение 4-5 суток назначался постельный режим с дальнейшим постепенным расширением режима двигательной активности. Дренажи удалялись не позднее 3-х суток, контрапертуры ушивались наглухо. Перевязки производились ежедневно до снятия швов. Во время перевязки учитывались местные тканевые реакции, пальпаторно определялась степень подвижности трансплантата, наличие транссудата. Скопление транссудата выявлялось нами в 33 наблюдениях ( 21 больной из 1-й группы, 12 - из 2-й), как правило, на 2-3 сутки после оперативного вмешательства. Транссудат эвакуировался толстой иглой пункционным способом в среднем количестве 7-10 мл, отправлялся на бактериологическое исследование, накладывалась давящая повязка. В большинстве случаев, после 5-6-кратной эвакуации скопления транссудата больше не отмечалось, пальпировалось плотное сращение тканей. Швы с операционной раны снимались на 10-е сутки.
Консервативная терапия включала в себя введение вазоактивных препаратов, диуретиков, десенсибилизирующая, противосудорожная терапия, препараты кальция.
Результаты краниопластики оценивались по данным комплексного послеоперационного обследования, учитывались послеоперационный койкодень, общий койкодень, данные электрофизиологического и рентгенологического контроля, неврологический статус, анализы крови и ликвора.
Результаты. У 113 больных (92%) операционная рана зажила первичным натяжением, швы были сняты на 9-11 сутки, у 8 больных первой группы и 2-х - второй группы заживление раны было вторичным. Скопление транссудата отмечалось у 21 больного первой группы и 12 - второй группы, транссудат образовывался в течение 4-5 суток и эвакуировался методом чрезкожной пункции у большинства больных в количестве не более 10мл. При бактериологическом исследовании транссудата была высеяна микрофлора (Staphylococcus aureus, Enterobacter cloacae, Proteus mirabilis, Staphylococcus haemolitikus, Staphylococcus epidermidis) и антибактериальная терапия проводилась с учетом чувствительности. Воспалительные осложнения в раннем послеоперационном периоде в виде нагноения костного лоскута с формированием свищевого хода развились у 6-и больных (4.9%) ( 4 из первой и 2 - из второй группы), у этих больных трансплантат удалялся в сроки до 30 суток из-за выраженных местных и общих реакций организма (лихорадка, лейкоцитоз), иссекался свищевой ход, устанавливалась система приливно-отливного дренирования раны. У 3-х больных первой группы в раннем периоде сформировался лигатурный свищевой ход, производилось удаление нагноившейся лигатуры и успешно лечилось консервативно с учетом чувствительности микрофлоры. В отдаленном периоде в первой группе отмечался рецидив формирования лигатурного свища через 5 месяцев, осложнившийся нагноением костного лоскута, который впоследствии был удален. Во второй группе в отдаленном периоде удаление трансплантата из-за возникновения воспалительного процесса в виде нагноения трансплантата, остеомиелита и формирования свища произведено 6-и больным в сроки до 1 года. Таким образом, в послеоперационном периоде общее количество септических осложнений со стороны трансплантата, приведшее его удалению в первой (опытной) группе равно 5 наблюдениям (8%), а во второй - 8 (13%) При изучении анамнеза болезни пациентов, которым удалялся трансплантат вследствие развившихся инфекционных осложнений, стало известно, что большинство из них имели подобные осложнения в остром периоде ЧМТ, а при КТ (ЯМРТ)-исследовании обращали внимание обширные рубцово-атрофические изменения или порэнцефалические кисты головного мозга в области трепанационного дефекта. Это позволяет пересмотреть и по возможности отсрочить сроки краниопластики для больных с воспалительным анамнезом и обширными тканевыми изменениями в области дефекта. Осложнения не связанные с реакцией тканей больного на трансплантат (сухой некроз кожного лоскута, нарушение мозгового кровообращения, внутричерепные гематомы, гидромы и интракраниальное смещение фрагментов трансплантата) наблюдались в первой группе в 4-х, а во второй - в 10-и случаях; в связи с этим повторное оперативное вмешательство потребовалось 5-и больным.
В послеоперационном периоде у больных исследовалось состояние крови и ликвора в динамике. При сравнении гемограмм в обеих группах при сходных цифрах СОЭ лейкоцитарная реакция в группе больных, которым производилась краниопластика демиелинизированной аллокостью, была выше, однако ядерный индекс сдвига, по которому следует судить о степени воспалительной реакции, в этой группе был достоверно меньше и менее выражена эозинофильная и лейкемоидная реакции , что указывает на меньшую степень иммунного ответа. Достоверные изменения биохимического состава крови у больных в обеих группах выявлены не были и в нашу сравнительную оценку не вошли.
Больные выписывались на амбулаторное лечение в поликлинике по месту жительства в удовлетворительном состоянии после снятия швов и проведения контрольных краниографии, электрофизиологического исследования. У всех больных с неосложненным течением отмечался удовлетворительный косметический эффект, частичный регресс неврологической симптоматики.
Электроэнцефалография в послеоперационном периоде выявляла выраженную положительную динамику в виде положительной перестройки биоэлектрической активности, тенденцией к нормализации ритма, уменьшением медленноволновой компоненты. Общий средний койко-день при краниопластике демиелинизированными аллотрансплантатами, включая больных с острой травмой и осложнениями, составил 34,53 дня, средний послеоперационный койко-день равен 21.0; общий средний койко-день при краниопластике формалинизированными аллотрансплантатами составил 37.74 дня, средний послеоперационный койко-день равен 22.13.
После выписки больные первой группы (краниопластика демиелинизированной костью) проходили контрольные обследования в сроки до 3-х лет, им производились краниография, ЯМРТ или КТ головного мозга, оценивался неврологический статус. Контрольное обследование в сроки от 3-х месяцев до 1 года после краниопластики, произведено нами 19-и больным; в сроки от 1 года до 2.5 лет - 5-и больным, через 3 года после краниопластики мы наблюдали одного больного. Все больные отмечали удовлетворительный косметический эффект после краниопластики и улучшение самочувствия в виде нормализации сна - 4 больных, повышения работоспособности - 19 больных, уменьшения мозжечковых расстройств- 16, уменьшения жалоб на головную боль - 17 больных. Во всех случаях был достигнут хороший косметический результат, о чем свидетельствовало соответствие конфигурации костей донора и реципиента. Пальпаторно трансплантаты не отличались от окружающих костей больного, симметрия во всех случаях была сохранена. Краниография производилась с целью выявления особенностей расположения и состояния трансплантата, определения взаимоотношения краев трансплантата и ложа реципиента в динамике. Положение костного лоскута правильное во всех наблюдениях. В период от 3-х до 6-и месяцев происходила резорбция краев трансплантата, а далее - замещение резорбированной части первичной костной тканью. К 2.5 годам после краниопластики по данным рентгенографии дефект выполнялся новообразованной костной тканью (рисунок 8).
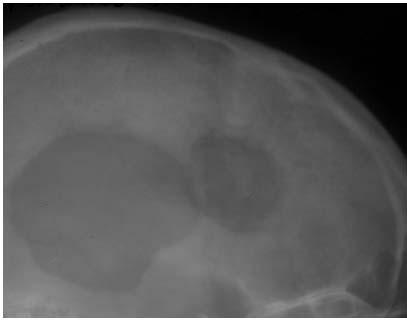
Рисунок 8a.
Краниограммы больного Л. до краниопластики.
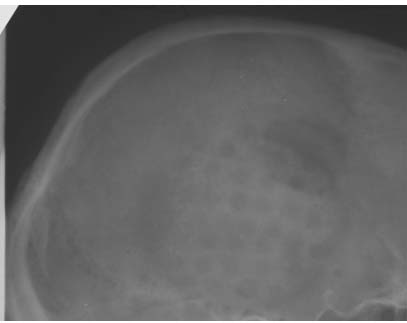
Рисунок 8b.
Краниограммы больного Л. через 3 года после краниопластики демиелинизированным аллотрансплантатом.
Заключение :
Проведенные нами исследования позволяют считать, что предложенный способ подготовки трансплантатов костей свода черепа к пересадке путем удаления миелоидного мозга обладает меньшими антигенными свойствами при сохранении биопластических свойств, доказанных в клинике и в эксперименте. Сравнение наших результатов с результатами краниопластики аллокостью, приготовленной по распространенной методике консервации в растворе формалина показало меньшее количество воспалительных осложнений (8% против 13%),меньшие общий и послеоперационный койко-дни. Исследования крови в послеоперационном периоде достоверно показали снижение индекса ядерного сдвига и отсутствие выраженной лейкемоидной реакции в исследуемой группе больных при сравнении с гемограммами контрольной группы, что является косвенным доказательством еe меньшей антигенной активности при отсутствии специфических иммунологических методик исследования. Большинство септических осложнений после краниопластики происходит у больных с воспалительным процессом в анамнезе. Предложенный метод следует рассматривать как альтернативную методику заготовки и способов хранения костной ткани, обеспечивающую наименьшую антигенную активность и наибольшую тканевую совместимость трансплантата, которая дает хороший лечебный и существенный экономический эффект.
Список литературы
1. Абакаров А.А. Экспериментально-морфологическое исследование судьбы трубчатого трансплантата, консервированного низкими температурами и слабыми растворами формалина // Стерилизация. Консервирование и трансплантация тканей. -Волгоград, -1975, -С.40-45.
2. Баталов О.А. Сравнительная оценка применения формалинизированных и замороженных аллотрансплантатов в детской ортопедии // Лечение травм и ортопедических заболеваний у детей/ Сборник научных трудов. -Горький. -1980. -С83-86.
3. Бухабиб Э.Б. Краниопластика у взрослых и детей алло- и аутотрасплантатами, консервированными замораживанием и формалином. Дисс. ... канд. мед. наук. -Л., 1978. - 176с.
4. Грушинин Р.А. Сравнительная оценка пластики свода черепа алло-, ауто- и гомопластическими материалами. Тезисы докладов к V Архангельской областной научно-практич. конф. травмат. ортопедов. -Архангельск, -1978. -С.81-83.
5. Зотов Ю.В., Касумов Р.Д., Савельев В.И., Бухабиб Э.Б., Зотов В.Ю. Хирургия дефектов черепа. -С-П. 1998.-184 с.
6. Зотов Ю.В., Щедренок В.В., Мирзаев М.А. Значение ауто- и гомопластики дефектов костей свода черепа во врачебно-трудовой экспертизе больных с последствиями черепно-мозговой травмы. // Организационные и методические вопросы врачебно-трудовой экспертизы и социально-трудовой реабилитации инвалидов с последствиями черепно-мозговой травмы. -Л.-1977.-т.41.- С.97-99.
7. Имамалиев А. С., Вяльцев В. В., Леибзон Н. Д. Краниопластика гомокостью. Баку, -1973.
8. Касумов Р.Д. Хирургия очаговых повреждений головного мозга. // Доклад на конференции "Актуальные проблемы современной неврологии, психиатрии и нейрохирургии", СПб. - ВМедА, 27-28.11.2003.
9. Кравчук А.Д. Реконструктивная и малоинвазивная хирургия последствий и осложнений черепно-мозговой травмы. Дисс. ...докт. мед. наук. -М., -2000.
10. Мельник Н.Ю. Первично-отсроченная краниопластика больных с тяжелой черепно-мозговой травмой. Дисс. ... канд. мед. наук. С.-П., -1998.
11. Парфентьева В. Ф. с соавт. Консервация костной ткани в растворах формалина слабых концентраций. // Методическое письмо. ЦИТО. М, -1970.
12. Парфентьева В.Ф., Разводовский ВД., Дмитриенко В.И. Способ консервации гомологичных костей. Авт. свид. ?202481. -1969. - 24 с.
13. Парфентьева В.Ф., Стаматин С.И., Якушина Л.П., Дмитриенко В.И. Метод консервирования костной ткани формалином и его применение при трансплантации // Материалы 6-го съезда травматологов-ортопедов УССР. -Киев. -1971. -С.173-177.
14. Савельев В.И. и соавт. Стерилизация биологических трансплантатов слабыми растворами формалина в сочетании с другими антисептиками. // Методические рекомендации ?142. - Ленинград. - 1982.
15. Турнер Ф. (1936), Оппенгеймер В. (1948) из статьи Б.В.Петровского и Д.Д.Венедиктова в книге "Проблемы аллопластики и гомопластики", Киев, 1967, с.30.
16. Удодов А. Н., Болтрукевич С. И., Колотнюк В. М. Рентгено-радиологическая характеристика формалинизированных трансплантатов при пластике инфицированных дефектов скелета // Трансплантация органов и тканей. - Тбилиси, 1979. - С. 234.
17. De la Camp H. Erreurs et dangers des plastics allogenes dans ka chirurgie des os et des articulations. // Lyon Chir. -1959. -V. 55. - ?5. - P.641-654.
18. Morrow J.D. Prosthetic cranioplasty infection due to Sporobolomyces. // Journal of the Tennessee Medical Association. -1994. -Vol.87. -?11, -P.466-467.
19. White J. Late complications following cranioplasty with alloplastyc plates. // Am.Surg., 1948. -128. -4. -P.743-755.
20. White J., Yachon D. - Delayed acrylic reconstruction of the skull in craniocerebral trauma. // J.Trauma. - 1970. - V. 10. - ?9. - P.780-786.


 Федеральное государственное бюджетное учреждение науки
Федеральное государственное бюджетное учреждение науки