С. А. КУЦЕНКО
ОСНОВЫ ТОКСИКОЛОГИИ,
Санкт-Петербург,
2002
|
ГЛАВА 5.4. КОЕРГИЗМ КСЕНОБИОТИКОВ
В реальных условия биологические системы, как правило, подвергаются воздействию более чем одного вещества. При этом большинство соединений (действуя в достаточной дозе) таким образом изменяют состояние организма, что последующий контакт с другими ксенобиотиками приводит к формированию эффектов качественно и количественно отличающихся, от вызываемых ими у интактных организмов, т.е. вызывают аллобиотические состояния. Например, уже однократный прием хлорорганического инсектицида алдрина мышами приводит к существенному изменению их чувствительности к фосфорорганическим инсектицидам (таблица 1).
Таблица 1. Влияние алдрина (16 мг/кг, однократно через рот, за 4 суток до испытания) на чувствительность белых мышей к некоторым ФОС
Вещество |
Смертность в группе (%) |
|
(мг/кг) |
Контроль |
После потребления алдрина |
Паратион (22) |
35 |
0 |
Параоксон (40) |
100 |
44,4 |
ТЭПФ (10) |
95 |
0 |
ДФФ (50) |
66,6 |
10 |
Гутион (15) |
84,6 |
15,4 |
ТОКФ (2000) |
60 |
20 |
ОМФА (25) |
60 |
70 |
(A.J. Triolo, J.M. Coon, 1966)
Для обозначения всех форм эффектов, развивающихся при совместном действии химических веществ, не зависимо от их строения и вида подвергающейся воздействию биологической системы, используют термин - коергизм. Проявления коергизма возможно как вследствие одномоментного (комбинация), так и последовательного (сукцессия) действия веществ на организм (рисунок 1).
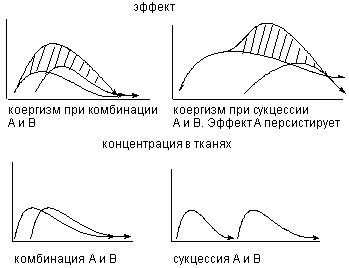
Рисунок 1. Коергизм при одномоментном и последовательном поступлении веществ "А" и "В" в организм.
Проявления коергизма по показателям качества и интенсивность развивающихся эффектов можно представить в форме трех основных типов: аддитивный синергизм (суммация), потенцирующий синергизм (потенцирование), антагонизм (таблица 2).
Таблица 2. Виды коергизма
Аддитивный синергизм |
Совместный эффект А и В равен сумме эффектов каждого из веществ. Вещества имеют либо близкую структуру, либо одинаковый механизм действия |
Потенцирующий синергизм |
Совместный эффект А и В больше суммы эффектов каждого из веществ. Вещества имеют различные механизмы действия. Возможно действие одного из веществ, как аллостерического активатора рецептора другого вещества |
Антагонизм |
Совместный эффект А и В существенно ниже суммы эффектов каждого из веществ вплоть до полного устранения эффектов |
1. Механизмы коергизма
Взаимное влияние химических веществ на развивающиеся эффекты может осуществляться во все периоды их действия и даже после выведения одного из них из организма.
1.1. Взаимодействие в период аппликации
В ряде случаев взаимодействие веществ происходит уже в период их аппликации, при этом образуются продукты с иными свойствами. Этот вариант взаимодействия называется псевдокоергизм. Наибольшее внимание с точки зрения токсикологии заслуживают такие явления как адсорбционное связывание ксенобиотика на поверхности биологически инертного вещества, химическое взаимодействие веществ, связывание ксенобиотика с макромолекулами.
Адсорбция на поверхности. Наиболее изученным примером подобного рода взаимодействия является процесс связывания токсиканта активированным углем. Адсорбционная емкость активированного угля объясняется его пористостью и большой площадью адсорбирующей поверхности (1000 см2/г угля). На поверхности локализуются участки связывания как гидрофильных, так и гидрофобных молекул. Полярные вещества, например ионы, низкомолекулярные спирты - плохо связываются активированным углем. Неполярные молекулы адсорбируются тем лучше, чем выше коэффициент распределения масло/вода. Активированный уголь занимает прочное место в системе оказания помощи отравленным в качестве "энтерального" сорбента, а также средства для проведения процедуры гемосорбции. Для обезвреживания принятого внутрь токсиканта применяют и другие адсорбирующие вещества, прежде всего ионообменные смолы. Их адсорбционная мощность во многом зависит от строения токсиканта (заряд активных групп), рН среды и времени контакта между веществом и смолой.
Химическое взаимодействие. В ряде случаев в основе коергизма лежит химическое взаимодействие веществ. Часто оно сопровождается снижением токсичности действующих соединений. Так еще в 18 веке для "обезвреживания" ядов и лечения отравлений предлагали использовать вещества, способные взаимодействовать с токсикантом в пробирке. Практическое значение имели реакции, приводящие к образованию нерастворимых, а потому практически безвредных, продуктов. Среди предлагавшихся средств была, в частности, сероводородная вода, приём которой при интоксикации сулемой считается эффективным мероприятием до настоящего времени (образуется нерастворимый сульфид ртути). Хорошо известно, что щелочи осаждают алкалоиды, ускоряют гидролиз эфиров, способствуют окислению легко окисляемых веществ. Алкалоиды осаждаются также солями йода и брома, дубильными кислотами, разрушаются нитритами. Токсичность люизита (хлоралкильное производное трехвалентного мышьяка), попавшего на кожу, существенно снижается при обработке пораженного участка концентрированным раствором йода (мышьяк окисляется до пятовалентного состояния).
В ряде случаев химическое взаимодействие ксенобиотиков может приводить к образованию более опасных соединений. Так, целый ряд веществ, такие как вторичные и третичные амины, N-алкиламиды, N-алкилгуанидины, взаимодействуя в кислой среде с нитритами, способны образовывать N-нитрозосоединения. При приеме внутрь таких веществ в желудке существенно возрастает концентрация нитрозосоединений. Эндогенно нитриты, как известно, образуются из нитратов под влиянием восстанавливающих микроорганизмов. Количество образующихся N-нитрозосоединений из экзогенных веществ, таким образом, зависит от их потребления, реакционной способности, времени нахождения в желудке, содержания нитритов и рН желудочного сока. При обычных условиях количество нитрозосоединений в ЖКТ не велико, поскольку их предшественники редко потребляются в больших количествах. Кроме того витамины С и Е, содержащиеся в пище, практически полностью блокируют процесс нитрозообразования. К веществам, стимулирующим процесс относится, в частности, тиоцианат, содержание которого повышено у курильщиков. Около 90% известных нитрозосоединений являются канцерогенами для животных различных видов.
1.2. Токсикокинетические механизмы коергизма.
Концентрация веществ в тканях пропорциональна содержанию их в крови и определяется соотношением скоростей поступления и оттока. В этой связи вещество "В" может влиять на токсикокинетику вещества "А" несколькими способами:
- изменять абсорбцию вещества "А" вследствие модификации проницаемости биологических барьеров или гемодинамики в органе (ткани). Алкалоз и ацидоз модифицируют захват химических веществ;
-вступать в химическое или физико-химическое взаимодействие с веществом "А", что приведет к изменению концентрации каждого из реагентов во внутренней среде организма. Действие ряда антидотов (комплексообразователи и др.) основано на этом принципе;
- вытеснять вещество "А" из связи с транспортными белками плазмы крови и увеличивать содержание токсиканта в биосредах (вытеснение дикумарола из связи с белками крови фенилбутазоном);
- изменять скорость и характер элиминации путем влияния на биотрансформацию и экскрецию вещества "А" (индукция микросомальных ферментов, назначение мочегонных средств).
1.2.1. Взаимодействие веществ при резорбции
Наиболее хорошо изучено взаимодействие веществ при их энтеральном поступлении. Частым примером рассматриваемой формы взаимодействия является влияние алкоголя на всасывание химических веществ. В основе эффекта лежит изменение подвижности желудочно-кишечного тракта и значений рН содержимого желудка. Этанол в концентрациях более 10% замедляет скорость опорожнения желудка, особенно в случае гиперосмотичности его содержимого. В концентрациях 1 - 10% спирт усиливает секрецию соляной кислоты, что приводит к понижению рН желудочного сока. Последнее обстоятельство сопровождается усилением всасывания токсикантов, обладающих свойствами слабых кислот (например производных барбитуровой кислоты). Этанол в высоких концентрациях действует противоположным образом. В свою очередь некоторые вещества (кофеин, дисульфирам) замедляют резорбцию этанола.
Поверхностно-активные вещества повышают всасываемость в желудочно-кишечном тракте жирорастворимых веществ. В опытах на крысах показана способность диалкилпропионамидов усиливать резорбцию преднизона и преднизолона, вероятно за счет формирования комплекса, лучше проникающего через липидные мембраны клеток слизистой оболочки.
В ряде случаев коергизм веществ при поступлении их в желудочно-кишечном тракте объясняется повреждением слизистой одним из токсикантов (агрессивные жидкости, иприты, соли некоторых металлов и др.), что приводит к нарушению свойств данного биологического барьера.
Веществом с выраженными "проводниковыми" свойствами, облегчающим проникновение веществ через биологические барьеры, является диметилсульфоксид (ДМСО). 15% раствор ДМСО в 2 - 8 раз усиливает резорбцию ксенобиотиков через кожу.
Изменение легочной резорбции, как правило, связано с нарушениями свойств альвеолярно-капиллярного барьера. Вещества, вызывающие раздражение дыхательных путей, отек легких, затрудняют проникновение в организм других газообразных соединений.
Различные сосудосуживающие препараты, такие как адреналин, норадреналин, вазопрессин, замедляют поступление веществ из мест аппликации. Напротив усиление резорбции может наблюдаться при совместном действии сосудорасширяющих веществ.
1.2.2. Коергизм веществ, в процессе распределения
1.2.2.1. Модификация связывания белками плазмы крови
Вещества существенно различаются по их способности связываться белками плазмы крови. От этого во многом зависят особенности их распределения в организме и токсичность. Так, многие фосфорорганические соединения связываются в плазме крови с алиэстеразами (Lauwerys, Murphy, 1969). Чем большая часть токсиканта связывается в крови, тем меньшая проникает в ткани, угнетает активность ацетилхолинэстеразы и тем менее пагубным, следовательно, оказывается токсическое действие ксенобиотика. Известно, что такие хлорорганические инсектициды как ДДТ, диэльдрин, хлордан увеличивают содержание алиэстераз в плазме крови экспериментальных животных (мыши, крысы, собаки). При этом токсичность фосфорорганических соединений для этих животных снижается (таблица 3).
Таблица 3. Процент связывания плазмой крови и токсичность фосфакола для мышей предварительно отравленных хлорорганическими инсектицидами
Инсектицид |
Фракция фосфакола, не связанная плазмой крови (%) |
Летальность в группе животных, отравленных фосфаколом (2 мг/кг) |
Контроль |
17,3 +/- 1,9 |
60 |
ДДТ (75 мг/кг) |
7,4 +/- 4,9 |
40 |
Диэльдрин (16 мг/кг) |
0,7 +/- 0,1 |
20 |
Хлордан (150 мг/кг) |
0,4 +/- 0,1 |
15 |
(A.J. Triolo et al., 1970)
Напротив, введение крысам три-о-крезил фосфата (ТОКФ), вещества полностью блокирующего места связывания ФОС с алиэстеразой (в дозе 125 мг/кг), но при этом не угнетающего активность ацетилхолинэстеразы, сопровождается повышением токсичности фосфакола примерно в два раза (Cohen, Murfy, 1974).
1.2.2.2. Изменение свойств тканей
Под влиянием многих химических веществ изменяется кровоснабжение тканей и органов, проницаемость биологических барьеров, электрический потенциал клеток, конформация макромолекул и т.д., то есть свойства, определяющие характер распределения веществ в организме. Примером такого действия является ослабление резерпином накопления дигитоксина в сердечной мышце, скелетных мышцах и печени. Пробеницид оказывает сильное влияние на характер распределения гликозидов в организме. Особое значение для развития токсического процесса имеет влияние коергистов на проницаемость гематоэнцефалического барьера. Так, хорошо известно, что нортриптилин, хлорпромазин усиливают проницаемость ГЭБ, в частности для манитола и инулина. Проницаемость этого барьера усиливается при тяжелых интоксикациях ФОС.
Вещества, обладающие свойствами ![]() -адреноблокаторов и одновременно высоким коэффициентом распределения в системе масло/вода (более 20), значительно угнетают транспорт глюкозы через мембрану эритроцитов.
-адреноблокаторов и одновременно высоким коэффициентом распределения в системе масло/вода (более 20), значительно угнетают транспорт глюкозы через мембрану эритроцитов.
1.2.2.3. Мобилизация биологически активных веществ
Одна из форм распределения ксенобиотика в организме - депонирование. Целый ряд веществ, особенно металлы (ртуть, свинец, мышьяк, кадмий, стронций и т.д.), некоторые жирорастворимые соединения (ДДТ, гексхлорбензол, дильдрин и т.д.), долго сохраняется в организме. Некоторые из этих веществ можно мобилизовать из мест связывания с помощью специальных средств. Так, выведение радия и стронция можно несколько усилить путем введения в организм кальция. Ион брома ускоренно выводится при нагрузке солями, содержащими ион хлора. Соли тяжелых металлов можно связать с помощью хелатирующих агентов, а затем образовавшиеся водо-растворимые комплексы удалить назначением мочегонных. Эффективность хелатирующих агентов при интоксикации тяжелыми металлами представлена в таблице 4.
Таблица 4. Эффективность некоторых комплексообразователей при интоксикации металлами.
Комплексон |
Mn |
Co |
Zn |
Cu |
Cd |
Au |
Pb |
Ca,Na ЭДТА |
+ |
|
|
+ |
+ |
|
++ |
Ca,Na ДТПА |
+ |
|
+ |
|
+ |
+ |
++ |
D-пенициламин |
|
+ |
++ |
++ |
|
++ |
|
|
Fe |
Ni |
Tl |
As |
Sb |
Hg |
|
Димеркаптол |
|
+ |
|
++ |
+ |
++ |
|
Диэтилдитиокарбамат |
|
++ |
++ |
|
|
|
|
Десфериоксамин |
++ |
|
|
|
|
|
|
(Wirth et al, 1971)
1.2.3. Коергизм в процессе биотрансформации
Часто коергизм является следствием взаимного влияния ксенобиотиков на процессы биотрансформации. Можно выделить следующие общие механизмы такого действия:
- конкурентное и неконкурентное угнетение активности энзимов, участвующих в биотрансформации веществ;
- повреждение субклеточных структур, ответственных за метаболизм ксенобиотиков (гладкий эндоплазматический ретикулум);
- угнетение синтеза или активация разрушения метаболизирующих энзимов;
- активация синтеза или угнетение разрушения метаболизирующих энзимов.
1.2.3.1. Угнетение активности энзимов, метаболизирующих ксенобиотики
Угнетение активности энзимов I и II фаз метаболизма ксенобиотиков приводит к изменению их биологической активности, продолжительности действия.
Реакции I фазы метаболизма. Два токсиканта или продукты их метаболизма могут взаимодействовать с одним и тем же метаболизирующим энзимом. В следствие этого замедляется элиминация либо одного, либо обоих коергистов. Угнетение превращения ксенобиотика "А" может быть следствием конкурентного (взаимодействие с активным центром) и неконкурентного (взаимодействие с аллостерическим центром) действия на энзим вещества "В".
Угнетение активности микросомальной этанолметаболизирующей окислительной системы энзимов (МЭОС) сопровождается снижением скорости элиминации спиртов и ряда других ксенобиотиков. Так, хлорпромазин, хлоралгидрат являются конкурентными ингибиторами алкогольдегидрогенезы. Циметидин (антагонист Н2-рецепторов) обладает высоким сродством к цитохром-Р450 зависимым оксидазам и МЭОС. Обе группы препаратов замедляют метаболизм этанола. В свою очередь этанол, находясь в организме, угнетает метаболизм некоторых ксенобиотиков метаболизируемых системой оксидаз смешанной функции (ОСФ). Так, на фоне действия этанола существенно замедляется элиминация мепрабомата, пентобарбитала, хлордиазепоксида, метадона, фенотиазина, кофеина, пропоксифена и др. В опытах in vitro этанол угнетает гидроксилирование анилина и фенобарбитала, N-деметилирование аминопирина и этилморфина. Этанол значительно замедляет биопревращение метилового спирта в организме, что позволяет использовать его, как антидот метанола.
Большая группа химических веществ является ингибиторами микросомальной биотрансформации ксенобиотиков (таблица 5).
Таблица 5. Ингибиторы микросомальной биотрансформации ксенобиотиков
SKF-525А Lilly-18947 CFT 1201 Ипрониазид Метирапон |
Пиперонилбутоксид 7,8-бензофлавон DPEA Пропоксифен Циметидин |
Среди веществ, угнетающих активность микросомальных энзимов, наиболее изученным является SKF-525, хотя механизм его действия до конца не понят. Полагают, что в основе действия лежит конкурентное и неконкурентное угнетение активности энзимов, неспецифическое повреждение гладкого эндоплазматического ретикулума.
Практическое значение явления угнетения энзимов, метаболизирующих ксенобиотики неоднозначно. Если в ходе метаболизма токсичность препарата падает (детоксикация), то угнетение биотрансформации сопровождается ростом его биологической активности (некоторые ФОС, гидразин и его производные, пропоксифен и др.). Если, напротив, в организме происходит биоактивация токсиканта (иприт, хлорированные углеводороды, кодеин, треморин и др.), блокада метаболизма приводит к снижению токсичности ксенобиотика. Необходимо иметь в виду, что многие ингибиторы микросомальных энзимов при длительном использовании выступают в качестве их индукторов. Такие эффекты получены для пропоксифена, этанола, SKF-525А и др. Таким образом, возможность использования на практике веществ, модулирующих активность энзимов метаболизма ксенобиотиков, ограничена неоднозначностью развивающихся при этом эффектов и неспецифическим характером действия.
Реакции II фазы метаболизма. Процессы коньюгации ксенобиотиков с глюкуронидом, сульфатом, глутатионом, ацетатом в значительно меньшей степени модифицируются в процессе коергизма. Тем не менее острое отравление дихлорэтаном или хроническая интоксикация этанолом сопровождаются истощением запасов глутатиона, что приводит к временному снижению резистентности в отношении других токсикантов. Реакции ацетилирования гидразина и его производных, прокаинамида, сульфаниламидов подавляется как при остром, так и хроническом приеме алкоголя.
1.2.3.2. Повреждение органов и тканей, метаболизирующих ксенобиотики
Целый ряд известных токсикантов (фосфор, четыреххлористый углерод, дихлорэтан, тиоацетамид и др.) помимо жирового перерождения печени вызывают и поражение энзиматических систем, участвующих в метаболизме ксенобиотиков. До 30% случаев острого поражения печени связано с приемом лекарств (см. раздел "Гепатотоксичность"). Поражение печени происходит либо исходным веществом, либо продуктами его метаболизма. К типичным представителям лекарств-гепатотоксикантов принадлежат хлорпромазин, толбутамид, хлорпропамид, метилтестостерон, аймалин, метотрекст, салицилаты, витамин А, сульфонамиды. Все эти вещества могут существенно повлиять на токсикокинетику и токсичность других ксенобиотиков. В опытах на животных установлено, что фенобарбитал может вызвать некроз печени, если одновременно назначают высокие дозы парацетамолла, изониазида, ипрониазида, фуросимида. Установлено, что не смотря на значительные повреждения печени, биотрансформация таких веществ как амидопирин, салициловая кислота, пентобарбитал может и не нарушаться. Из этого следует, что связь между детоксицирующей и другими функциями печени не является абсолютной.
1.2.3.3. Индукция энзимов, метаболизирующих ксенобиотики
Некоторые ксенобиотики могут увеличивать активность энзимов, участвующих в биотрансформации других чужеродных соединений, т.е. выступать в роли индукторов (см. выше). Как правило, к числу индукторов относятся вещества с различным строением, но растворяющиеся преимущественно в липидах и имеющие большой период полувыведения (таблица 6).
Таблица 6. Некоторые лекарственные препараты, обладающие свойствами индукторов и ингибиторов энзимов, метаболизирующих ксенобиотики
Индукторы |
Ингибиторы |
барбитураты |
Аллопуринол |
Благодаря низкой специфичности энзимов, метаболизирующих ксенобиотики, многие индукторы повышают скорость метаболизма не только чужеродных, но и эндогенных веществ.
Выраженность индукции в значительной степени определяется видовыми и индивидуальными особенностями организма и является дозо-зависимым эффектом. Как правило, периоду активации энзимов (продолжительность: 24 - 72 часа), при назначении индукторов, предшествует кратковременный (до 6 - 12 часов) период угнетения их активности. Ингибиторы микросомальных энзимов блокируют эффект индукторов.
Так как следствием метаболизма может являться и детоксикация и биоактивация вещества, то и токсикологические последствия индукции ферментов биопревращения при воздействии различных ксенобиотиков на организм не однозначны (таблица 7).
Таблица 7. Изменение токсичности некоторых фосфорорганических инсектицидов для белых крыс на фоне предварительного приема фенобарбитала (50 мг/кг в течение 5 дней)
Вещество |
Величина ЛД50 (мг/кг) |
Соотношение ЛД50 в опытной и контрольной группах |
|
Контроль |
Опыт (прием Фенобарбитала) |
||
Паратион |
2,5 |
7,3 |
2,9 |
Метилпаратион |
7,0 |
8,0 |
1,1 |
Систокс |
1,4 |
5,8 |
4,1 |
Гутион |
8,7 |
11,4 |
1,3 |
Делнав |
17,2 |
118,7 |
6,9 |
Фосдрин |
1,2 |
2,4 |
2,0 |
Этион |
25,9 |
302,6 |
11,7 |
Тритион |
10,1 |
66,5 |
6,6 |
ОМПА |
28,7 |
14,5 |
0,5 |
Малатион |
619,4 |
949,9 |
1,5 |
Фолекс |
124,0 |
171,9 |
1,4 |
(K.P. DuBois, F. Kinoshita, 1968)
1.2.3. Коергизм веществ при их выведении
1.2.3.1. Выведение через почки
Вещества, повышающие артериальное давление и усиливающие почечный кровоток (дофамин, пурины, сердечные гликозиды и др.) ускоряют процесс почечной фильтрации ксенобиотиков, несвязанных с белками плазмы крови. Вытеснение коергистом ксенобиотика из связи с протеинами крови также увеличивает скорость их выведения.
1.2.3.1.1. Канальцевая реабсорбция
При угнетении салюретиками канальцевой реабсорбции воды и электролитов уменьшаются предпосылки, в силу снижения концентрации, для обратной диффузии токсикантов и их метаболитов из первичной мочи в кровь. Одновременно уменьшается время контакта выводимых веществ с эпителием почечных канальцев, что также способствует ускоренному выведению ксенобиотиков с мочой (форсированный диурез).
Решающим фактором, определяющим скорость выведения многих веществ через почки, является рН мочи, изменяющаяся в норме от 4,5 до 7,5. При длительном назначении молочнокислого натрия, ацетата натрия, аскорбиновой кислоты кислотность мочи увеличивается; антациды, триметамол и др. вызывают ощелачивание мочи. Как уже указывалось, с изменение рН значительно изменяется степень ионизации слабых кислот с рКа от 3,0 до 7,0 и оснований с рКа от 7,5 до 10,5. Изменение степени диссоциации соединений сказывается на их растворимости в воде и липидах. Вследствие этого вещества, подщелачивающие мочу угнетают реабсорбцию слабых кислот и активируют - слабых оснований и, напротив, вещества понижающие рН мочи угнетают реабсорбцию оснований и активируют - слабых кислот.
1.2.3.1.2. Канальцевая секреция
Канальцевая секреция представляет собой активный процесс, при котором коергисты могут выступать в качестве конкурентов за системы переносчиков в почках. Система переноса органических анионов обеспечивает секрецию целого ряда биологически активных веществ (см. раздел "Токсикокинетика").
В таблице 8 представлены данные, демонстрирующие замедление элиминации почками пенициллина при одновременном назначении ряда других веществ.
Таблица 8. Влияние некоторых веществ на скорость элиминации почками пенициллина (600 мг/кг) у человека.
Препараты (суточная доза, г) |
Период полувыведения (мин) |
|
до препарата |
после препарата |
|
пробеницид (2,0) |
40,4 |
104,3 |
фенилбутазон (0,6) |
42,8 |
102,2 |
сульфинпиразон (0,6) |
42,6 |
70,3 |
индометацин (0,075) |
42,7 |
52,2 |
Переносчики соединений свойствами слабых оснований участвуют элиминации таких веществ как хинин, хинидин, имипрамин, неостигмин и т.д. Возможно их взаимное влияние на скорость элиминации.
1.2.3.2. Печеночная экскреция
Гепатоциты, как и клетки почечного эпителия, с помощью низкоселективных транспортных систем, ускоряют выведение из печени в желчь некоторых анионов и катионов. Здесь также существует возможность конкуренции между ксенобиотиками за систему переноса через биологические барьеры. Так, желчегонные вещества блокируют выведение билирубина; бромсульффталеин понижает билиарную экскрецию варфарина. Однако токсикологическое значение этого феномена невелико, поскольку явление внутрипеченочной циркуляции нивилирует развивающийся эффект.
1.3. Токсикодинамические механизмы коергизма
1.3.1. Взаимодействие на уровне рецепторов
Коергизм веществ на уровне рецепторов может реализовываться следующими способами:
- путем действия на один и тот же рецептор биологически активной макромолекулы (энзима, ионного канала, рецептора эндогенного биорегулятора); участвующие коергисты выступают в качестве агонистов или конкурентных антагонистов;
- путем действия на разные сайты связывания одного и того же рецептора биологически активной молекулы; участвующие коергисты выступают либо в качестве агонистов, либо неконкурентных антагонистов.
Интерпретация феномена коергизма на уровне рецепторов возможна с нескольких позиций.
1. Классическая модель основывается на представлении об известном химическом подобии агонистов и антагонистов и их комплементарности к соответствующим рецепторам. Концепция подтверждается рядом наблюдений над действием серий препаратов, возбуждающих и блокирующих синаптические рецепторы нейромедиаторов центральной и периферической нервной системы (холинергические, катехоламинергические, ГАМК-ергические и др.). Конкурентные антагонисты имеют большую молекулярную массу, чем агонисты, и образуют более прочную связь с рецепторами, блокируя их.
2. Конформационная модель исходит из того, что рецептор может находиться в двух состояниях: активном (R+) и неактивном (R-), между которыми в норме существует динамическое равновесие. Активный рецептор взаимодействует с агонистом, неактивный - преимущественно с антагонистом. Вследствие такого взаимодействия агонисты сдвигают равновесие в сторону преобладания активной формы рецептора, антагонисты - неактивной. Частичные агонисты могут взаимодействовать с обеими формами рецептора, следовательно, одновременно и возбуждать и блокировать систему (рисунок 2).
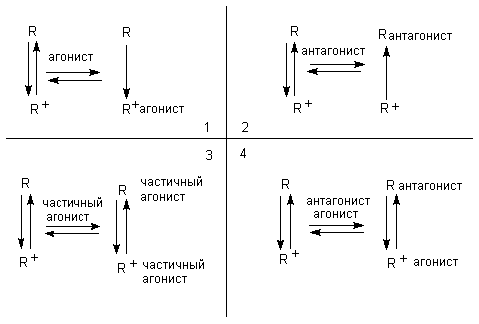
Рисунок 2. Взаимодействие рецептора с агонистом и антагонистом:
1. Агонист сдвигает равновесие в сторону R+
2. Антагонист сдвигает равновесие в сторону R
3. Частичный агонист частично изменяет соотношение R+ и R
4. Конкуренция между агонистом и антагонистом
Эта модель позволяет понять, почему между агонистами и антагонистами должны существовать структурные различия. В некоторых случаях равновесие между состояниями R- и R+ рецепторов определяется факторами окружающей среды. Так, состояние опиатных рецепторов in vitro определяется концентрацией ионов натрия в инкубационной среде. Действие неэлектролитов на липидные мембраны также, возможно, сопровождается изменением соотношения активной и неактивной форм рецепторов в нервной системе.
Возможны и другие гипотезы, объясняющие явление коергизма на уровне рецепторов.
1.3.1.1. Конкуренция за рецепторы одного типа
Принципиально возможные механизмы конкуренции двух токсикантов на уровне рецептора представлены на рисунке 3.
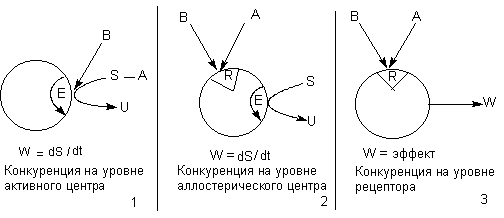
Рисунок 3. Механизмы конкуренции двух токсикантов на уровне рецептора
В качестве рецептора для токсикантов (А, В) могут выступать активный (Е) и аллостерический (R) центры энзима, участвующего в превращении субстрата (S) и собственно рецепторы для эндогенных биорегуляторов (нейромедиаторов, гормонов). Биологическая активность энзима проявляется скоростью превращения субстрата, рецепторного протеина - инициацией физиологической реакции (выделение секрета железой, сокращение мышечного волокна, изменение потенциала биологической мембраны и т.д.)
При изучении серии веществ по их способности конкурировать за рецептор можно прийти к определенным типам коергизма (таблица 9).
Таблица 9. Типы коергизма токсикантов при действии на рецептор
Действие на биосистему только А |
Действие на биосистему как А, так и В |
Изменение эффекта |
Вид коергизма |
++
++
++ |
++
+
0 |
0
-
-- |
конкурентный синергизм конкурентный дуализм конкурентный антагонизм |
1.3.1.2. Коергизм при действии ксенобиотиков на разные участки рецепторной молекулы
Низкомолекулярные вещества способны атаковать биологически активные протеины различными способами. Образуемые при этом связи токсиканта и протеина являются как специфическими (с активным центром энзима, аллостерическим центром энзима, рецепторной структурой и т.д.), так и неспецифическим (с сульфгидрильными, гидроксильными, аминогруппами белков и т.д.). Рецепторный ареал биологически активного протеина часто представляет собой относительно небольшой участок связывания субстрата и окружающий его периферический отдел. Решить вопрос о специфичности и неспецифичности (конкурентности и неконкурентности) действия токсиканта на рецепторную молекулу, как правило, чрезвычайно сложно. Лишь для некоторых энзимов и рецепторных протеинов изучены молекулярные механизмы их взаимодействия с отдельными токсикантами. Так, установлены закономерности взаимодействия ФОС с активным центром холинэстеразы и влияние так называемых реактиваторов холинэстеразы (оксимов) на этот процесс (см. раздел "Противоядия").
Показано, что морфин и N-аллилморфин очевидно реагируют с различными участками одной и той же молекулы опиатного рецептора. Антагонизм между веществами, по-видимому, основан на том, что рецептор к морфину при взаимодействии с одним из этих соединений принимает конформацию, затрудняющую взаимодействие с другим.
N-этилмалеинимид, р-хлормеркуробензоат, цистеин, ионы ртути и мышьяка и другие вещества способны связываться с SH-группами белковых молекул, изменяя их конформацию. Таким образом, функциональные свойства молекул изменяются вследствие модификации структуры рецептора.
В холинэргических рецепторах пункт связывания ацетилхолина соседствует с -S-S- связью белковой молекулы, восстановление или окисление которой оказывает влияние на способность рецептора взаимодействовать с АХ. Восстановить дисульфидную связь можно с помощью ![]() -меркаптоэтанола, окислить - гипосульфитом натрия. В опытах in vitro оба вещества существенно изменяют реакцию биопрепаратов на ацетилхолин, а также токсиканты, обладающие холиномиметической и холинолитической активностью.
-меркаптоэтанола, окислить - гипосульфитом натрия. В опытах in vitro оба вещества существенно изменяют реакцию биопрепаратов на ацетилхолин, а также токсиканты, обладающие холиномиметической и холинолитической активностью.
Различные функциональные группы белков легко взаимодействуют с алкилирующими агентами, например с ипритами, формальдегидом, промежуточными продуктами метаболизма хлорированных углеводородов (дихлорэтан и т.д.), арсенидами, солями ртути и т.д. По большей части это ковалентные, и, следовательно, практически необратимые связи. Если рецепторная структура инактивирована за счет ковалентного связывания с токсикантом, то восстановление её активности возможно только путем синтеза de novo.
В ходе токсикологических экспериментов при изучении коергизма между неконкурентными токсикантами, как правило, выявляется их способность одновременно изменять как сродство биомишени к эндогенным субстратам и ксенобиотикам-агонистам, так и активность соответствующей биомолекулы.
1.3.2. Коергизм на уровне реактивных систем и целостного организма
Часто в основе коергизма лежит взаимодействие токсикантов с различными структурами, связанными функционально. Выраженность этой функциональной связи может быть различной. Это могут быть биомолекулы, входящие в структуру синапса (пресинаптические рецепторы, регулирующие выброс нейромедиатора и его обратный захват, ферменты, разрушеющие нейромедиатор в синапсе, постсинаптические рецепторы, взаимодействующие с нейромедиатором и т.д.), рецепторы различных синаптических образований, участвующие в регуляции клетки или органа (холинергические и катехоламинергические системы миокарда, различные нейромедиаторные системы ЦНС и т.д.), биомишени для токсикантов, локализованные в различных анатомических образованиях, связанных функционально (нервная ткань - мышечная ткань; сосудистая система - почки и т.д.). Если токсиканты действуют на различные рецепторные системы и при этом усиливают эффект со стороны биологической системы (клетки, ткани, органа, организма в целом), то говорят о функциональном (физиологическом) синергизме; если эффект ослабляется - о функциональном (физиологическом) антагонизме. Так, ингибиторы холинэстеразы усиливают проведение нервного импульса в холинэргических синапсах, холинолитики подавляют этот процесс. Вещества, относящиеся к упомянутым группам, являются функциональными антагонистами (действуют противоположным образом в пределах одной анатомической структуры - синапса). Одновременное назначение ![]() -адреноблокаторов и диуретиков сопровождается выраженным снижением артериального давления - на лицо функциональный синергизм веществ.
-адреноблокаторов и диуретиков сопровождается выраженным снижением артериального давления - на лицо функциональный синергизм веществ.
2. Представление данных, получаемых в ходе изучения явления коергизма
Для представления данных отражающих коергизм веществ можно использовать различные диаграммы, например комбинационный квадрат (Loewe).
Изучается соотношение доз коергистов "А" и "В" при их совместном действии, по показателю - способность вызывать некий определенный эффект, оцениваемый количественно (например ЛД50 или ЕД50). В системе координат, где абсцисса - относительная доза "А", а ордината - относительная доза "В", выстраивается линия, связывающая дозы "А" и "В", которые вызывают при совместном введении определенный эффект (например, 50% летальность в группе экспериментальных животных). Эта линия называется изоболой. По её виду можно судить о характере коергизма между веществами. Как правило, диаграмма Loewe позволяет осуществлять сравнение веществ с близким механизмом действия (рисунок 4).
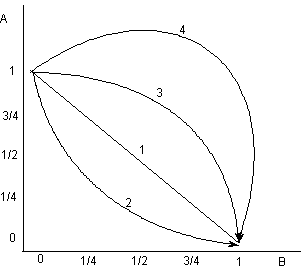
Рисунок 4. Комбинационный квадрат Loewe с 4 изоболами:
1. Аддитивный синергизм;
2. Сверхаддитивный синергизм - потенциация;
3. Относительный антагонизм;
4. Абсолютный антегонизм.
Ордината: относительные дозы "В", вызывающие эффект установленной интенсивности в присутствии "А".
Абсцисса: относительные дозы "А", вызывающие аналогичный эффект аналогичной интенсивности в присутствии "В".
Возможно и иное представление получаемых данных (рисунок 5). В данном случае по оси абсцисс откладывают соотношение относительных доз "А" и "В", а по оси ординат выраженность эффекта, развивающегося при совместном введении токсикантов, также в относительных величинах (части от максимального).
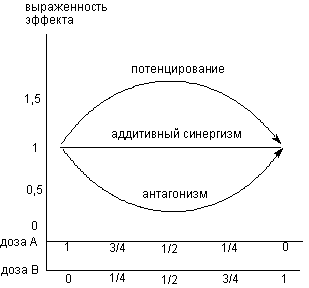
Рисунок 5. Выраженность эффекта при совместном действии "А" и "В" в различных дозах
3. Токсикологическое значение явления коергизма
1. На производстве, в быту или в природных условиях на человека, как правило, одновременно действует большое количество химических веществ. Поскольку существует явление коергизма практически никогда эффект такого сочетанного действия не является простой суммой эффектов, наблюдаемых при изолированном воздействии каждого из токсикантов в отдельности. Это существенно затрудняет нормирование химических воздействий (определение ПДК и т.д.) и вообще снижает научную ценность токсикометрических данных, полученных применительно к одному токсиканту, для принятия экспертных решений. Явление коергизма - одна из основных причин значительной неопределенности суждений при оценке риска, связанного с действием вредных факторов на организм, популяцию, экосистему. В особо ответственных случаях приходится специально изучать в эксперименте последствия воздействия на биосистему определенных смесей, однако ограниченность такого подхода очевидна.
2. Явление коергизма лежит в основе разработки средств этиотропной (антидоты), патогенетической и симптоматической терапии отравлений. В качестве средств, эффективных при интоксикации тем или иным веществом, могут выступать лишь химические соединения, обладающие антагонистическими отношениями с токсикантом, развивающимися по одному из рассмотренных выше механизмов.
|