С. А. КУЦЕНКО
ОСНОВЫ ТОКСИКОЛОГИИ,
Санкт-Петербург,
2002
|
ГЛАВА 5.2. ВЛИЯНИЕ УСЛОВИЙ ПРОВЕДЕНИЯ ЭКСПЕРИМЕНТА И КАЧЕСТВА СРЕДЫ ОБИТАНИЯ НА ТОКСИЧНОСТЬ
Биологические системы постоянно обмениваются с окружающей средой веществом, энергией, информацией и потому их функциональное состояние находится в полной зависимости от состояния среды. В определенных границах биосистемы способны приспосабливаться к изменению свойств окружающей среды. При этом изменяются их биохимические, физиологические, морфологические характеристики, а, стало быть, и чувствительность к ксенобиотикам. Колебания чувствительности к ядам в зависимости от условий, в которых яд действует, отмечаются на всех уровнях организации жизни: клеточном, органном, организменном, популяционном. Наибольшее количество данных по этому вопросу получено в эксперименте применительно к целостному организму лабораторных животных различных видов. Имеются отдельные наблюдения на людях. Проблема практически не изучена на уровне популяций, хотя в будущем это может иметь очень большое значение для решения практических экотоксикологических задач.
Свойства среды влияют на все звенья цепи формирования и развития токсического процесса: резорбцию, распределение, метаболизм, элиминацию ксенобиотика, взаимодействие его с рецепторами, активацию патологических и репаративных процессов. Наиболее значимые факторы представлены в таблице 1.
Таблица 1. Факторы, оказывающие влияние на токсичность ксенобиотиков
1. Биологические или биосоциальные |
2. Физические |
3. Химические |
Между действием отдельных факторов в реальных условиях трудно провести границу. Так, временная периодичность в изменении чувствительности организма к ксенобиотику зависит как от геофизических факторов (смена дня и ночи, времен года), так и от биосоциальныхъ факторов, генетических особенностей организма и т.д.
1. Питание
Количество и качество потребляемой пищи оказывают сложное влияние на чувствительность человека и животных к токсикантам. У лиц, находящихся на диете богатой белками, но бедной углеводами период полупревращения феназона уменьшается на 7 часов (с 16,2 до 9,5 часов), теофиллина с 8,1 до 5,2 часов. При переходе на диету с противоположным соотношением белков и углеводов в пище период полупревращения ксенобиотиков возрастает. Дефицит в пище белков и липидов приводит к снижению интенсивности метаболизма ксенобиотиков печенью. В этой связи токсичность веществ, подвергающихся в организме биоактивации, понижена у лиц находящихся на белковой диете. Содержание углеводов в потребляемой пище мало сказывается на интенсивности процесса метаболизма ксенобиотиков и на их токсичности.
Хроническое недоедание понижает резорбцию веществ в желудочно-кишечном тракте и скорость их метаболизма. Развивающаяся гипоальбуминемия приводит к снижению фракции веществ, связывающихся альбуминами плазмы крови. В итоге, элиминация токсикантов путем биотрансформации угнетается, но почечная экскреция проходит с большей скоростью.
Голод редуцирует активность энзимов печени, разрушающих чужеродные соединения. У крыс, уже через 16 часов голода отмечается отчетливое снижение активности процесса N-деметилирования ксенобиотиков, причем у самцов эффект выражен сильнее, чем у самок. Вероятно, в период голодания нарушается активирующее действие андрогенных гормонов на микросомальные энзимы.
2. Условия содержания экспериментальных животных
В условиях эксперимента удалось установить, что токсичность веществ зависит от того, содержатся ли они изолированно или группой. Токсичность некоторых веществ, действующих на ЦНС, при изолированном содержании животных ниже (таблица 2).
Таблица 2. Токсичность некоторых веществ (мг/кг; через рот) для мышей при изолированном и групповом содержании
Вещества |
Групповое содержание |
изолированное содержание |
ЛД50изол/ЛД50груп |
Фенамин |
34 |
232 |
6,8 |
Иногда механизмы, лежащие в основе явления, затрагивают глубинные физиологические характеристики организма. Так, установлено, что при продолжительной изоляции мышей в хвостатом ядре мозга возрастает содержание дофаминергических рецепторов. Этим можно объяснить усиление двигательной активности животных и более высокую толерантность их к дофаминомиметикам (фенамин, кофеин, мескалин). Изоляция приводит также к уменьшению числа мест связывания серотонина в коре головного мозга, промежуточном мозге, коре мозжечка, что сопровождается усилением агрессивности. Количество ГАМК-рецепторов, через которые реализуется судорожная активность бициклофосфатов, норборнана, пикротоксина и др. в коре головного мозга уменьшается; количество рецепторов, через которые осуществляется этанол-потенцирующее действие бензодиазепинов и барбитуратов, снижается в промежуточном мозге и коре мозжечка.
Однако часто можно обнаружить и достаточно простые причины наблюдаемых эффектов. Например, при изолированном содержании животных выше теплоизлучение организма, а влажность окружающего воздуха ниже. Температурный режим и влажность среды, в свою очередь, могут оказывать существенное влияние на токсичность веществ, что подтверждается экспериментально. Так, ЛД50 морфина сульфата при 19О для животных (мыши) при изолированном и групповом содержании составляет 520 и 490 мг/кг соответственно; при 29О - 434 и 368 мг/кг.
На групповых животных (крысы, мыши) неблагоприятным образом сказывается шум. Ограничение пространства и свободы движений действует на них как стрессорный фактор.
3. Содержание в стерильных условиях
У животных, рожденных и выращенных в стерильных условиях, отсутствует кишечная флора. Это является причиной полного прекращения у них процессов внутрикишечного метаболизма ксенобиотиков, в частности деглюкуронидирования конъюгатов, и подавления внутрипеченочной циркуляции некоторых чужеродных веществ. Полагают, что этим можно объяснить значительное снижение (в сравнении с контролем) частоты появления опухолей кишечника и молочной железы, развивающихся при введении животным 3,2-диметил-4-аминофенола. В обычных условиях канцероген подвергается в печени N-гидроксилированию, а затем и глюкуронидированию. После попадания метаболита в кишечник с желчью происходит его расщепление под влиянием ![]() -глюкуронидазы кишечной флоры и образование исходного вещества, активно реабсорбирующегося слизистой ЖКТ. Длительная внутрипеченочная циркуляция диметил-аминофенола и, следовательно, продолжительное пребывание в организме, способствуют реализации канцерогенного действия токсиканта. У животных, содержащихся в стерильных условиях, внутрипеченочная циркуляция подавлена. Вследствие этого существенно ускоряется экскреция вещества из организма, снижается вероятность развития патологических процессов.
-глюкуронидазы кишечной флоры и образование исходного вещества, активно реабсорбирующегося слизистой ЖКТ. Длительная внутрипеченочная циркуляция диметил-аминофенола и, следовательно, продолжительное пребывание в организме, способствуют реализации канцерогенного действия токсиканта. У животных, содержащихся в стерильных условиях, внутрипеченочная циркуляция подавлена. Вследствие этого существенно ускоряется экскреция вещества из организма, снижается вероятность развития патологических процессов.
4. Периодические изменения чувствительности к токсикантам
Многие биологические процессы, такие как синтез ДНК, РНК, белков, нейромедиаторов, активность энзимов, параметры гемодинамики, рН мочи, количество электролитов в моче, температура тела, количество форменных элементов в крови, гормональная активность, интенсивность обмена веществ и т.д. - постоянно, достаточно ритмично изменяются во времени. У человека и животных выявлено более 100 ритмических изменений различных характеристик и функций организма. Естественно, что чувствительность организма к токсикантам также постоянно изменяется.
4.1. Циркадные ритмы
Циркадными, называются суточные колебания показателей жизнедеятельности, обусловленные генетическими механизмами и выявляемые даже на клеточном уровне. У различных видов живых существ характер суточной ритмики различен. Так, у людей максимальное содержание кортикостероидов в крови определяется утром, в момент пробуждения, у крыс - вечером, при приближении темного времени суток, т.е. также в конце периода покоя. Эти колебания регулируются, в основном, сменой светлого и темного времени суток, а также некоторыми биосоциальными факторами. В основе суточных колебаний чувствительности человека и высших животных к токсикантам лежат изменения активности энзимов, метаболизирующих ксенобиотики, содержания гормонов в крови и нейромедиаторов в нервной ткани, спонтанной подвижности кишечника и многие другие причины.
Так, токсичность ингибиторов холинэстеразы для крыс коррелирует с содержанием ацетилхолина в ткани мозга животных. В те периоды, когда содержание нейромедиатора высоко, возрастает токсичность ингибиторов. Напротив, токсичность холинолитика атропина возрастает, когда содержание ацетилхолина снижается. Продолжительность сна мышей, вызванного гексобарбиталом, максимальна между 8 и 14 часами суток, когда активность ферментов, метаболизирующих препарат, снижена, и минимальна - между 20 и 2 часами, на фоне максимальной активности энзимов. Адренэктомия приводит к прекращению циркадной ритмики активности микросомальных энзимов и чувствительности к ксенобиотику, что связано с прекращением колебания содержания в крови кортикостероидных гормонов.
Поскольку чувствительность организма к различным токсикантам изменяется вследствие колебания характеристик разных биологических процессов, общая временная зависимость изменения токсичности для всех ксенобиотиков отсутствует, и для каждого вещества в отдельности, в случае необходимости, определяется экспериментально.
С учетом сказанного, исследования по оценке острой токсичности веществ следует проводить в одно и тоже время суток.
4.2. Годичные ритмы
Годичные изменения чувствительности к токсикантам особенно характерны для холоднокровных животных. Однако некоторые колебания чувствительности отмечаются и у теплокровных. Например, у крыс линии Wistar в течение года определяются достоверные изменения чувствительности к токсическому действию никотина. Не исключено, что это связано с колебаниями среднесуточной температуры и влажности воздуха. Максимальная токсичность выявляется в теплое время года.
5. Температура окружающего воздуха
Скорость течения различных биологических процессов изменяется в зависимости от изменения температуры не одинаково. Температурный коэффициент Q10 показывает на сколько меняется скорость того или иного процесса при изменении температуры на 10О.
Q10 = Vt/V(t-10)
Q10 для физико-химических процессов находится в интервале 1,1 - 1,5, химических реакций - 2 - 3, а для отдельных биохимических процессов и выше. Диффузия токсикантов и их метаболитов через биологические барьеры, будучи физическим процессом, в меньшей степени зависит от температуры, чем течение, скажем, биохимических реакций превращения веществ в тканях. Однако диффузия является важным механизмом поступления большинства ксенобиотиков в организм. Поэтому, при более высоких температурах резорбция химических веществ, в целом, идет с большей скоростью, чем при низких. В этой связи охлаждение места действия токсиканта (место укуса ядовитых змей, насекомых) иногда может замедлить скорость резорбции яда и развития поражения. На таблице 3 представлены данные, поясняющие это положение.
Таблица 3. Содержание метадона в тканях экспериментальных животных (мкг/г), через 30 минут после подкожного введения, в зависимости от температуры окружающего воздуха.
Вид животных |
Ткань |
Доза (мг/кг) |
18О |
29О |
|
крыса |
мозг |
|
2,0 |
3,1 |
55 |
мышь |
мозг |
|
4,8 |
6,7 |
40 |
(F. Herr et al., 1956)
Резорбция через кожу также существенно возрастает при повышении температуры. Так, 4 из 5 обезьян переносят зарин в концентрации 115 мг/м3 при экспозиции в течение 30 минут и температуре окружающего воздуха 25О; при 38О при тех же условиях выживает 1 из 5 животных. Однако, анализируя подобные результаты, следует помнить, что в еще большей степени чем на диффузию ксенобиотика через гистогематические барьеры, температура влияет на интенсивность кровоснабжения тканей, то есть на процесс доставки к ним токсиканта.
С изменением температуры изменяется реактивность организма. Изменяется, например, частота и сила сердечных сокращений. Это, в свою очередь, приводит к изменению реакции сердечной мышцы на действие токсиканта. Так, в опытах in vitro, g-строфантин в концентрациях 0,05 - 0,2 мкг/мл при 37О перфузируемого раствора повышал изометрическое систолическое напряжение папиллярных мышц сердца кошки. При 27О эффект не наблюдался. Причина феномена состоит в том, что при низкой температуре спонтанная недостаточность сердечной мышцы развивается значительно медленнее, чем при 37О, а действие гликозидов отчетливо прослеживается только при недостаточности миокарда. Выраженность действия адреналина и ![]() -адреноблокаторов на изолированное предсердие и папиллярные мышцы сердца кролика также существенно зависит от температуры.
-адреноблокаторов на изолированное предсердие и папиллярные мышцы сердца кролика также существенно зависит от температуры.
Интенсивность биотрансформации ксенобиотиков возрастает при предварительном охлаждении экспериментальных животных, при этом в крови у них возрастает уровень гормона щитовидной железы (индуктор метаболизма ксенобиотиков), а в печени - содержание цитохромаР-450. Установлено, что за сутки в организме крысы при 35О окружающего воздуха выделяется около 1,7 мкг тироксина, при 20 - 25О - 5,2 мкг, в условиях холода - 9,5 мкг.
Хроническая гипертермия также сопровождается изменением токсикокинетических характеристик многих ксенобиотиков. При изолированном содержании крыс в течение месяца при температуре окружающего воздуха близкой к 35О С существенно снижается клиаренс пропранолола, антипирина, теофиллина, дигоксина. С другой стороны кинетика фенитоина в аналогичных условиях не изменяется.
Теоретические основы влияния температуры окружающего воздуха на токсичность ксенобиотиков для млекопитающих разработаны недостаточно. Известно, что температура среды сказывается на температуре тела животных, однако зависимость не носит линейного характера. Так, в опытах на мышах изучали зависимость ректальной температуры животных от температуры окружающего воздуха. При температуре окружающего воздуха 20О ректальная температура составляла около 36О, при 25О - снижалась до 34О, и при 35О - составляла более 37О (W. Usinger, 1957). В этой связи следует ожидать, что чувствительность экспериментальных животных и человека к токсикантам будет определяться не только величиной температуры окружающего воздуха, но и продолжительностью воздействия, выходящего за рамки адаптационного комфорта.
Как правило в большей степени зависит от температуры окружающей среды токсичность веществ, влияющих на температуру тела. Существенно влияют на температуру тела токсиканты, влияющие на механизмы нейромедиаторной передачи нервных импульсов в холинэргических, катехоламинергических, серотонинергических синапсах. Токсичность этих веществ, в свою очередь, существенно зависит от температуры. Так, токсичность ФОС (понижают температуру тела) для крыс снижается при содержании животных в условиях компенсируемой гипертермии (до 300 С). Напротив токсичность холинолитиков (повышают температуру тела) в этих условиях увеличивается. Ухудшается при повышении температуры окружающего воздуха и переносимость и некоторых симпатомиметиков (нафтизин). Однако характер зависимости и механизм, лежащий в основе эффекта, в каждом случае должны устанавливаться эмпирически. Так метадон понижает температуру тела мыши. Однако его токсичность при 29О в 2,9 раза выше, чем при 18О.
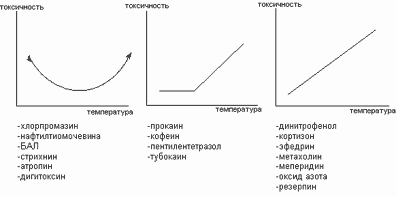
Допуская значительные упрощения, можно выделить три основных вида зависимости между значением температуры окружающей среды и токсичностью ксенобиотиков для экспериментальных животных (рисунок 1). Каждому из этих типов соответствуют определённые токсикодинамические механизмы.
Рисунок 1. Основные виды зависимости между температурой окружающей среды и токсичностью ксенобиотиков
|