С. А. КУЦЕНКО
ОСНОВЫ ТОКСИКОЛОГИИ,
Санкт-Петербург,
2002
|
ГЛАВА 4.3. РАСПРЕДЕЛЕНИЕ КСЕНОБИОТИКОВ В ОРГАНИЗМЕ
После резорбции в кровь вещество в соответствии с градиентом концентрации распределяется по всем органам и тканям. Распределение - динамический процесс, его направленность во многом определяется соотношением содержания ксенобиотика во внешней среде, на месте аппликации, в крови и тканях. По большей части вещества распределяются в организме неравномерно. Неодинаково и время пребывания ксенобиотиков в различных органах и тканях. Некоторые избирательно накапливаются в том или ином органе, ткани, даже клетках определенного типа. Так, ботулотоксин избирательно связывается с нервными окончаниями холинэргических нервных волокон, 6-гидроксидофамин - накапливается в катехоламинэргических нейронах ЦНС, свинец, стронций - в костях и т.д. Причем если время нахождения первых двух токсикантов в соответствующих клетках насчитывает несколько часов - суток, то последние агенты могут сохраняться в костной ткани годами. Однако строение, физические свойства и химически состав клеток во многом одинаковы, поэтому такое неравномерное распределение ксенобиотика в организме или избирательное накопление в отдельных тканях встречается не так часто.
Токсический процесс далеко не всегда характеризуется повреждением именно тех структур, в которых вещество накапливается в наибольшем количестве. Выраженность токсического эффекта пропорциональна концентрации ксенобиотика в месте действия на биологически значимую "структуру-мишень". Для того, чтобы эффект был сильным необходима высокая концентрация вещества в "биофазе" чувствительных рецепторов. Например, чтобы вызвать отравление, в основе которого лежит нарушение деятельности сердца, буфотоксин должен накопиться в сердечной мышце. Его содержание в мозге, печени, поджелудочной железе практически не имеет значение для развития острого токсического процесса. При интоксикации диэтиламидом лизергиновой кислоты (ДЛК) менее 1% вещества поступает в мозг, но именно со стороны ЦНС выявляются изменения, составляющие основу острого отравления. Свинец, накопившийся в костях, практически не обладает биологической активностью.
1. Принципы распределения
На процесс перехода токсикантов из крови в ткани (и наоборот) влияют следующие структурно-функциональные особенности органов:
- свойства стенок их капиллярного русла;
- степень вазкуляризации и интенсивность кровоснабжения органов;
- свойства клеток, формирующих орган, и особенно клеточных мембран;
- кислотно-основные свойства тканей;
- степень сродства молекулярных элементов тканей к токсикантам.
На характер распределения ксенобиотиков в организме, кроме того, оказывают влияние вид животного, его пол, возраст и др.
1.1. Проникновение веществ через стенку капилляра
Водо-растворимое вещество, циркулирующее в крови, не диффундирует в ткани, если радиус молекулы превышает радиус пор стенки капилляров. Как правило, это случается с высокомолекулярными соединениями: токсикантами белковой природы и т.д. (см. выше). Такое же исключительно внутрисосудистое распределение характерно для низкомолекулярных веществ, если в крови они образуют большие агломераты частиц или связываются с белками плазмы крови. Как уже указывалось, в различных органах стенки капилляров имеют различные свойства, а следовательно и различную проницаемость для химических веществ.
1.2. Значение особенностей кровоснабжения органов
Распределение токсикантов в первые минуты - часы после их поступления в организм, до достижения стационарной фазы, в значительной степени определяется характером кровоснабжения органов.
Объем крови, протекающей через различные органы в единицу времени далеко не одинаков (рисунок 1).

Рисунок 1. Интенсивность кровоснабжения различных органов и тканей
Количество диффундирующего из крови в ткань вещества определяется суммарной площадью капиллярного русла ткани. Для различных органов и тканей площадь капиллярного русла также не одинакова (таблица 1).
Таблица 1. Площадь капиллярного русла различных органов собаки (см2/г ткани)
Мозг |
Почки |
Печень |
Легкие |
Мышцы |
240 |
350 |
250 |
250 |
70 |
Более того, даже внутри одного и того же органа степень вазкуляризации отдельных участков может существенным образом различаться. Так, средняя длина капиллярного русла (в мкм) на 100 мкм3 сырой ткани мозга крысы составляет:
N. paraventricularis - 2023
N. supraopticus - 1960
Cortex - 1000
др. отделы гипоталамуса - 180 - 500
Сразу после введения вещества попадают в органы, богато снабжаемые кровью. Однако в дальнейшем они перераспределяются в соответствии с другими свойствами тканей, например, наличием специальных механизмов захвата веществ, высоким содержание структур, связывающих ксенобиотик и соотношением жира и воды в органе или ткани. Так, в первые минуты после внутривенного введения собаке 25 мг/кг тиопентала, вещество в большом количестве определяется в печени (до 90%) и практически отсутствует в жировой ткани. Однако уже через 3 часа в печени и жире содержится примерно одинаковое (до 30%) количество вещества (B.B. Brodie, C.A.M. Hogben, 1957).
Конечное распределение токсикантов, длительно сохраняющихся в организме, не зависит от особенностей кровоснабжения органов.
1.3. Проникновение через клеточную мембрану
Токсиканты, хорошо растворяющиеся в липидах легко проникают не только через гистогематические барьеры, но и через клеточные мембраны и попадают внутрь клеток.
Водо-растворимые соединения могут попасть в клетки лишь через поры клеточных мембран. Размер пор клеточных мембран значительно меньше пор стенок капилляров. Поэтому среди водо-растворимых веществ можно выделить такие, которые проходят через стенки капилляров, но не проникают внутрь клеток, накапливаясь в экстрацеллюляроном пространстве тканей. К таким, в частности, относятся инулин, манит, ионы SO42-, SCN- и т.д. Инулин и манит могут использоваться в этой связи для экспериментального определения объема экстрацеллюлярного пространства. Он оценивается в среднем в 15 - 20% от объема тела.
На способность веществ проникать через клеточные мембраны влияет величина их рКа (см. выше). Если в ходе патологического процесса изменяется кислотность плазмы крови, то одновременно изменяется и соотношение ионизированной и неионизированной форм молекул, циркулирующих в крови, и, следовательно, характер их распределения в организме. Так, при ацидозе количество неионизированных молекул кислот увеличивается, щелочей - уменьшается. Напротив, при алкалозе увеличивается количество неионизированной формы молекул слабых оснований. В этой связи при ацидозе в клетки поступает большее количество кислых токсикантов (щавелевая кислота при отравлении этиленгликолем, муравьиная кислота при отравлении метанолом и т.д.), а при алкалозе - слабых оснований.
1.4. Относительная растворимость в системе масло/вода
Вещества, хорошо растворимые в жирах, прежде всего, накапливаются в жировой ткани и тканях, богатых липидами (ЦНС). Эта закономерность хорошо прослеживается для многих лекарственных препаратов (например, производных барбитуровой кислоты), пестицидов и экополютантов (полигалогенированные ароматические углеводороды и т.д.). При анализе результатов изучения токсикокинетики веществ необходимо учитывать, что у нормального человека жировая ткань составляет 15 - 20% веса тела, у тучных людей - до 50% и более.
Соединения с высоким значением коэффициента распределения в системе масло/вода плохо переходят из липидной фазы в водную. Для них жир является своеобразным депо в организме. В этом причина низкого содержания ряда токсикантов в плазме крови, и одновременно длительного сохранения их в организме. С этим можно связать накопление в организме, например, ДДТ, диоксина, галогенированных дибензофуранов и т.д. Токсикологическое значение может иметь накопление в жировой ткани малотоксичных пищевых добавок, экополютантов и т.д. При определенных ситуация, сопряженных с резким снижением содержания жира в организме, эти вещества могут выходить из депо и оказывать токсическое действие.
1.5. Распределение в соответствии с химическим сродством
Вещества, с высоким химическим сродством к определенным молекулам, молекулярным комплексам и т.д., накапливаются в тканях, содержащих такие молекулы в больших количествах. Типичным примером является угарный газ (СО), избирательно взаимодействующий с гемопротеинами, содержащими двухвалентное железо и, в частности, с гемоглобином. Вещество накапливается в силу этого преимущественно в крови отравленных.
Стронций и свинец - металлы, в известном отношении близкие кальцию. При поступлении в организм они первоначально накапливаются в паренхиматозных органах. Однако поскольку кальций подвержен постоянному обмену, Sr и Pb постепенно замещают его в тканях и в соответствии с химическим сродством депонируются преимущественно в костях.
Распределение веществ модифицируется внешними условиями. Так, CN- обладает высоким сродством к гемопротеинам, содержащим трехвалентное железо. При ингаляции синильной кислоты CN- связывается с цитохромокидазой, каталазой, пероксидазой тканей. Однако, если с помощью метгемоглобинообразователей (азотистокислый натрий, алкиламинофенолы и т.д.) перевести железо гемоглобина в трехвалентную форму, СN- будет связываться преимущественно с метгемоглобином, т.е. накапливаться в крови.
2. Объем распределения
Если вещество в дозе "Д" ввести внутривенно и оно, в соответствии со способностью преодолевать гистогематические барьеры и клеточные мембраны, распределится в жидкостях и тканях организма, то, основываясь на определении его концентрации в плазме крови "С", можно рассчитать кажущийся объем распределения (Vd).
Сравнивая Vd с объемами различных компартментов, можно ориентировочно оценить, в каком из них будет преимущественно накапливаться вещество. У взрослого человека масса воды составляет 50 - 70% от массы тела (у мужчины - 60 - 65%, у женщины - 50 - 55%) (табл. 2). Объем плазмы крови равен 4 - 4,5%, экстрацеллюлярной жидкости - 11 - 13%.
Таблица 2. Относительный объем компартментов организма
Компартмент |
Объем (%) |
Внутриклеточная вода |
34 |
Межклеточная вода: |
|
Вода плазмы крови |
4 |
Жир |
20 |
Прочие жидкости |
19 |
Если вещество не растворимо в липидах, оно будет накапливаться в водной фазе: плазме крови VК или одновременно внеклеточной VE и внутриклеточной VC жидкости. Если допустить, что вода этих жидкостей имеет одинаковую способность растворять химические соединения, можно ожидать, что:
С = Д/(VК + VE + VC)
Если вещество распределится только внутри сосудистого русла:
С = Д/(VК),
если экстрацеллюлярно:
С = Д/(VК + VE).
В ходе токсикологических исследований принято определять абсолютный и относительный объемы распределения:
Vабс = Д/С (л);
Vотнос = Д/С М (л/кг), где
Доза - "Д" выражается в граммах; концентрация - "С" в г/л; масса тела - "М" в кг.
При умножении Vотнос на 100 получаем его значение в % от массы тела.
Например, после внутривенного введения химического вещества (Д = 0,5 г) человеку массой 60 кг при установления состояния равновесия в организме концентрация его в плазме крови равна 0,04 г/л. В результате имеем:
Vабс = 0,5/0,04 = 12,5 л
Vотнос = 12,5/60 = 0,208 , т.е. 20,8%
Таким образом, можно предположить, что соответствующее соединение главным образом накапливается экстрацеллюлярно.
Значения объемов распределения некоторых веществ в организме человека представлены на таблице 3.
Таблица 3. Объем распределения некоторых ксенобиотиков
Вещество |
Vd (л/кг) |
Вещество |
Vd (л/кг) |
Дигитоксин |
0,5 |
Окспренолол |
6,0 |
(цит. по Марковой И.В., 1998)
Многие вещества имеют относительный объем распределения более 70 и даже более 100%. Этот на первый взгляд лишенный смысла факт, указывает на то, что соединения активно связываются со структурными элементами клеток, депонируются в тканях (преимущественно в жировой). Концентрация их в плазме крови при этом остается низкой.
Поэтому до изучения растворимости вещества в липидах, его способности связываться с белками крови и тканей и т.д., интерпретация результатов носит сугубо предварительный характер. Поскольку содержание жира у разных людей неодинаково объем распределения для липофильных веществ также подвержен существенным колебаниям.
Анализ величины объема распределения сопряжен и с другими трудностями. Так, если вещество достаточно быстро удаляется из организма, существенное значение приобретает правильность выбора времени определения его концентрации в плазме. Если это сделано слишком рано, не успевает установиться равновесие в системе распределения ксенобиотика, если слишком поздно - большая часть вещества будет элиминирована из организма.
Для преодоления трудностей необходимо использовать дополнительные методические приемы, в частности определять величину полуэлиминации токсиканта (см. ниже).
3. Связывание с белками крови
Токсикант, попавший в кровоток, может вступать во взаимодействие с белками и клетками крови, при этом изменяются его токсикокинетические характеристики. В практическом отношении особый интерес представляет взаимодействие ксенобиотиков с протеинами плазмы крови.
3.1. Белки плазмы крови
Плазма крови человека содержит около 75 мг/мл белка. Основная масса представлена альбуминами: 35 - 55 мг/мл, выполняющими, главным образом, транспортные функции. К числу других групп относятся белки свертывающей системы крови, иммуноглобулины, белки системы комплемента, ингибиторы протеолиза, липо- и гликопротеины. Взаимодействие этих белков с ксенобиотиками приводит к понижению концентрации свободно циркулирующих в плазме веществ, вследствие чего понижается фракция токсиканта, способного к диффузии в ткани. Липофильные вещества, взаимодействуют в основном с липопротеинами. Водо-растворимые токсиканты прежде всего связываются с альбуминами и кислыми ![]() 1-гликопротеидами. Концентрация последних в плазме крови составляет около 0,9 мг/мл. Потенциальные участки связывания заряженных молекул ксенобиотиков белками представлены в таблице 4.
1-гликопротеидами. Концентрация последних в плазме крови составляет около 0,9 мг/мл. Потенциальные участки связывания заряженных молекул ксенобиотиков белками представлены в таблице 4.
Таблица 4. Потенциальные участки связывания ионизированных молекул ксенобиотиков белками
Участки связывания |
Строение групп |
Число участков связывание на молекулу белка |
Аспартат, глутамат |
-СООН |
101 |
Тирозин |
-О- |
18 |
Цистеин |
-S- |
0,7 |
Гистидин |
-NH+- |
17 |
Лизин |
-NH3+ |
57 |
Аргинин |
=NH2 |
22 |
Терминальные группы |
-NH3 |
1 |
Tanford et al. 1955
Альбумины плазмы крови человека хорошо растворяются в воде. Их молекулярная масса - около 66000 Д. Они состоят из 585 остатков аминокислот. Третичная структура альбуминов фиксируется 17 дисульфидными связями. При рН 7,4 эти белки находятся в форме анионов. Большинство попавших в кровь веществ фиксируются на альбуминах, не зависимо от того являются они нейтральными, кислыми или основными соединениями.
Выделяют 6 основных центров связывания ксенобиотиков на молекуле альбумина. Различные центры отличаются друг от друга неодинаковым сродством к веществам с различными значениями константы рКа, механизмами взаимодействия с ксенобиотиками, различной кривой насыщения связи, числом на молекуле белка, величинами константы диссоциации комплекса белок-ксенобиотик. Так, центр связывания 1-го типа содержит два различных акцепторных ареала. Здесь связываются такие вещества как варфарин, бензодиазепины. На 1 молекулу альбумина приходится 1 - 3 центра связывания 1-го типа.
Физиологическая функция альбуминов состоит в связывании свободных жирных кислот и билирубина, циркулирующих в крови. Эти вещества могут влиять на процесс взаимодействия белков с ксенобиотиками. Так, жирные кислоты ослабляют связывание гликозидов или бензодиазепинов с альбуминами. Билирубин влияет на фиксацию варфарина и т.д.
Кислые ![]() 1-гликопротеиды состоят из одной полипептидной цепи и остатка углевода. Молекулярная масса белков - около 41000. Полисахаридный фрагмент молекулы составляет около 38% ее массы. Гликопротеиды связывают, прежде всего, молекулы, обладающие свойствами слабых оснований. Из-за невысокой концентрации этих белков в плазме процесс связывания ими химических веществ быстро насыщается.
1-гликопротеиды состоят из одной полипептидной цепи и остатка углевода. Молекулярная масса белков - около 41000. Полисахаридный фрагмент молекулы составляет около 38% ее массы. Гликопротеиды связывают, прежде всего, молекулы, обладающие свойствами слабых оснований. Из-за невысокой концентрации этих белков в плазме процесс связывания ими химических веществ быстро насыщается.
Липопротеиды прежде всего связывают жирорастворимые вещества. Основной центр связывания - липидный фрагмент молекулы.
Кроме указанных, в плазме крови содержатся специфические транспортные белки, активно связывающие некоторые токсиканты (церулоплазмин, металотионеины и т.д.).
3.2. Характеристики связывания ксенобиотиков
Перечень связывающихся на белках крови молекул простирается от простых неорганических до сложных макромолекулярных соединений. Достаточно хорошо это явление изучено применительно к разнообразным лекарственным препаратам (таблица 5).
Таблица 5. Связывание некоторых лекарственных препаратов белками плазмы крови
Вещество |
Связывание (%) |
Вещество |
Связывание (%) |
Трамал |
5 |
Дезипрамин |
70 - 90 |
( цит. по Марковой И.В., 1998)
Связь веществ с белками - спонтанно протекающая реакция, не требующая затрат энергии и зависящая только от их строения.
В основе процесса, как правило, лежит установление гидрофобных, реже ионных и водородных, связей между участниками взаимодействия. Установлено, что с увеличением молекулярной массы ксенобиотика, длины алкильных радикалов в молекуле вероятность его связывания белками возрастает. Включение в молекулу галогенов делает связь вещество-белок более прочной. Влияние различных заместителей возрастает в ряду: Cl< Br< J. Наличие N-ацильных радикалов в молекуле также упрочивает связь. Галогенированные углеводороды прочно связываются с альбуминами, но еще прочнее с липопротеинами. Липофильные ФОС связываются и с альбуминами и с липопротеинами (таблица 6).
Таблица 6. Связывание ксенобиотиков различного строения с альбуминами и липопротеинами
Токсикант |
Количество связавшегося вещества (%) |
Связано альбумином (%) |
Связано ЛПНП* (%) |
Связано ЛПВП** (%) |
ДДТ |
99,9 |
35 |
35 |
30 |
* ЛПНП - липопротеины низкой плотности
**ЛПВП - липопротеины высокой плотности
(Malwall B.P., Guthrie F.E., 1981)
Связывание с белками - один из важных факторов, определяющих особенности токсикокинетики некоторых металлов. Ключевую роль здесь играют низкомолекулярные, содержащие SH-группы металлсвязывающие белки - металлотионеины, усиленно синтезируемые в ответ на поступление целого ряда металлов (Сd, Zn и т.д.) в организм. Эти белки активно соединяются с металлами, формируя ковалентную связь, и при острых воздействиях снижают их токсичность. Так, предварительное введение экспериментальным животным цинка, индуцирующего синтез металлотионеинов, защищает их от смертельной дозы Сd (Gunn et al., 1964). Печень и почки - органы, в которых синтез металлотионеинов проходит с наивысшей скоростью. Именно в этих органах первоначально накапливается и большая часть металла, поступившего в организм. При длительном поступлении в организм (хорошо изучено на примере кадмия) комплекс металл-металлотионеин появляется в крови. Источником циркулирующего в крови комплекса, как полагают, является печень. Интересно отметить, что накопление связанного кадмия в почках в большом количестве приводит к развитию нефропатии. Комплекс Сd-металлотионеин при системном введении экспериментальным животным вызывает некроз клеток эпителия проксимального отдела почечных канальцев. Вероятно, в этих структурах происходит захват циркулирующего в крови Сd-металлотионеина. У грызунов, которым хронически вводили Сd, нефропатия не развивалась до тех пор, пока концентрация комплекса Сd-металлотионеин в сыворотке крови не становилась достаточно высокой.
3.3. Конкурентные отношения при взаимодействии ксенобиотиков с белками
Если в растворе белка находится несколько химических соединений, между ними могут возникнуть конкурентные отношения за образование связи с протеинами. Эту закономерность легко проследить на примере сульфониламидных препаратов и фенобарбитала. При увеличении концентрации барбитурата (с 0,85 мМ до 3, 25 мМ) количество сульфониламида, связавшегося с альбумином плазмы крови человека уменьшается. Подобные отношения отмечаются между веществами как близкого, так и совершенно разного строения, вместе с тем не являются облигатными для всех соединений. Более того, в ряде случаев выявляется усиление связи веществ с протеинами в присутствии других соединений. Так, галотан повышает способность альбумина связывать самые различные химические вещества, вероятно модифицируя его конформацию.
Известна способность веществ к взаимному вытеснению из связей с протеинами. Это особенно характерно для слабых кислот, например таких лекарственных препаратов, как фенилбутазон, сульфинпиразон и т.д. Вследствие высвобождения из связи с белком концентрация действующего соединения в плазме крови возрастает.
Значение рассматриваемого явления определяется следующими факторами:
- относительным сродством вещества и его конкурента к белкам плазмы крови с одной стороны, и тканям - с другой;
- объемами, в которых распределяются вещества;
- скоростью разрушения комплекса токсикант-белок.
Если объем распределения вещества невелик и при этом в плазме крови обнаруживается его высокая концентрация в сравнении с тканями, то вытеснение из связи с белками крови заметно изменит содержание соединения в тканях. Для веществ с большим объемом распределения вытеснение практически не скажется на характере распределения в организме.
При попадании в кровь нескольких биологически активных веществ, конкурирующих за один и тот же участок связывания на белках плазмы крови, возможна существенная модификация их токсичности и продолжительности действия. Так, при введении экспериментальным животным фенилбутазона или его производных, на фоне предварительного введения переносимой дозы антикоагулянтов (варфарина, кумарина), отмечается вытеснение последних из связи с белками плазмы крови, что приводит к гибели животных.
При изучении явления конкуренции веществ необходимо учитывать, что ксенобиотики помимо связи с белками плазмы крови, как правило, образуют комплексы и с тканевыми протеинами (таблица 7).
Таблица 7. Связывание веществ (0,1 М) in vitro 50% гомогенатом мышечной ткани, 25% раствором гемоглобина и плазмой крови человека
Соединения |
Связывание (%) |
||
Мышцы |
Гемоглобин |
Плазма |
|
Салициловая кислота |
43,3 |
50,4 |
82,1 |
(H. Kurz, 1978)
Введение в организм конкурентов связывания может привести к высвобождению соединения не только из комплекса с белками плазмы, но и тканей. В этом случае диффузионный градиент высвобождаемого вещества может измениться самым неожиданным образом (таблица 8).
Таблица 8. Изменение количества связанного веществ (0,1 мМ) при добавлении в инкубат фенилбутазона (0,1 мМ)
Вещество/белок* |
Без фенилбутазона (%) |
В присутствии фенилбутазона (%) |
Фенпрокурон |
|
|
* 25% раствор гемоглобина; 50% гомогенат мышечной ткани
** М - человек; К - кролик. (Н.Kurz, 1978)
3.4. Биологические последствия связывания токсиканта белками плазмы крови
Связывание веществ белками крови имеет определенные токсикокинетические и токсикодинамические последствия.
1. Распределение. Простые вещества, связанные с белками крови, приобретают кинетические характеристики этих белков. Содержание таких веществ в тканях, как правило, невелико, объем распределения - мал (плазма крови). Напротив, у веществ, плохо связывающихся с белками, объем распределения и содержание в тканях высокие. Если распределение вещества в организме не подчиняется законам диффузии и осуществляется путем активной его экстракции из крови тканями (например, печенью или почками), то связывание белками может даже способствовать активному захвату такого ксенобиотика (например, захват почками комплекса кадмия с металлотионеинами).
2. Клиаренс. Клиаренс (скорость "очищения" плазмы - Cl) определяется интенсивностью кровотока (F) и скоростью экстракции вещества органами выведения (Е):
Cl = F E;
Е = (СА - СV)/CА , где
СА и СV - концентрация вещества в артериальной и венозной крови соответственно.
Если Е имеет высокие значения (более 0,7 - 0,8), клиаренс в значительной степени зависит от интенсивности кровотока. При этом, соотношение между свободной и связанной фракциями токсиканта в крови играет подчиненную роль. Так, даже если в печени и почках из плазмы экстрагируются преимущественно несвязанная форма, то, вероятно, быстрая диссоциация комплекса вещество-белок приводит к практически незатрудненному выведению вещества.
Если Е - менее 0,2 - 0,3, клиаренс определяется, прежде всего, концентрацией несвязанного вещества в плазме крови. Интенсивность кровотока имеет меньшее значение.
3. Выведение через почки. Если вещество не подлежит активному захвату почечной тканью, то в случае связывания с белками его экскреция будет затруднена, поскольку капиллярная мембрана почечных клубочков не проницаема для белка. В первичную мочу путем фильтрации будут поступать лишь свободные молекулы.
В этой связи если диссоциация комплекса вещество-белок проходит быстро, то связывание ксенобиотика протеинами крови мало сказывается на его выделении через почки, если же образовалась прочная связь, это может стать лимитирующим фактором почечной экскреции.
4. Биологическое действие. Биологическое действие вещества пропорционально части молекул, вступивших во взаимодействие с биологически значимыми молекулами-мишенями. Эта часть, в свою очередь является функцией концентрации свободных, не связавшихся с биосубстратом, молекул. Все структурные элементы организма, способные образовывать комплексы с ксенобиотиками, являются конкурентами специфических рецепторов для токсикантов, понижают их биологическую активность. Это в полной мере относится к белкам крови и тканей. Последние существенно превосходят белки крови по способности неспецифически связывать ксенобиотики и потому в большей степени влияют на токсикодинамические характеристики веществ.
5. Аллергизация. Некоторые ксенобиотики, образуя ковалентные связи с молекулами белков, изменяют структуру протеинов и их конформацию, белки приобретают свойства антигенов для собственного организма. С учетом этих представлений обсуждается возможность объяснения аллергизации организма низкомолекулярными соединениями, наблюдаемая при их повторном воздействии (см. раздел "Иммунотоксичность").
4. Связывание клетками крови
В крови токсикант может вступать во взаимодействие не только с белками плазмы, но и форменными элементами крови и прежде всего с эритроцитами. При этом возможно: 1. Связывание вещества клеточной мембраной эритроцитов (связывание с белками мембраны, растворение в липидах клеточной мембраны); 2. Проникновение соединения внутрь клетки, связывание с её содержимым, взаимодействие с гемоглобином.
Фиксация веществ на поверхности эритроцитов отчасти обусловлена наличием отрицательного заряда на внешней поверхности мембраны. Он формируется многочисленными связанными с мембраной молекулами мукополисахаридов. Положительно заряженные вещества, особенно содержащие четвертичный атом азота в молекуле (алкалоиды и т.д.), активно взаимодействуют с поверхностью эритроцитов.
Прохождение ксенобиотиками клеточной мембраны эритроцитов подчиняется общим закономерностям (см. выше). Из-за высокой концентрации гемоглобина в эритроците вся внутриклеточная вода связана этим белком и не принимает участие в растворении ксенобиотиков. В этой связи, возможности эритроцитов фиксировать гидрофильные молекулы в форме раствора внутри клетки, ограничены.
5. Проникновение ксенобиотиков в ЦНС
Проникновение в ЦНС целого ряда химических соединений, в основном водорастворимых и тем более заряженных, затруднено или даже невозможно. Это обусловлено особенностями строения гистогематического барьера между кровью и тканью мозга, носящего здесь название "гематоэнцефалический барьер", и барьера, отделяющего цереброспинальную жидкость от кровяного русла (гематоликворный барьер).
5.1. Гематоэнцефалический и гематоликворный барьеры.
Общая площадь поверхности капилляров мозга велика и составляет в среднем 52 см2/г ткани, причем в различных структурах этот показатель не одинаков. Так, в белом веществе мозга обезьяны площадь капилляров составляет 38 см2/г ткани, а в коре головного мозга - 192 см2/г. Большая площадь контакта сосудистого русла и ткани мозга объясняет почему в мозг быстро проникают жирорастворимые ксенобиотики, для которых эндотелий сосудов, базальная мембрана и мембраны астроцитарной глии не представляют преграды. Вместе с тем перечисленные структуры образуют барьер, который не преодолим для очень многих ксенобиотиков.
Гематоэнцефалический барьер формируется благодаря уникальным особенностям анатомических структур головного мозга.
Во-первых, эндотелий капиллярного русла головного мозга отличается от эндотелия других органов чрезвычайно тесным контактом клеток друг с другом. Эффективный радиус пор капилляров мозга значительно меньше, чем в других тканях и составляет, например, у кролика 0,7 - 0,9 нм. Крупные молекулы не в состоянии проникать через эндотелиальный барьер. Водо-растворимые и заряженные молекулы могут проходить непосредственно через биомембраны и цитоплазму эндотелиальных клеток только в том случае, если имеют малые размеры (CN-). В норме эндотелиальные клетки мозга лишены способности к пиноцитозу. Лишь при некоторых патологических состояниях (гипоксия) в ЦНС в эндотелии образуются пиноцитарные вакуоли, при этом возрастает проницаемость гематоэнцефалического барьера, увеличивается уязвимость мозга для действия токсикантов.
Во-вторых, капилляры мозга плотно окутаны отростками астроцитарной глии. Астроцитарная оболочка препятствует проникновению гидрофильных ксенобиотиков из крови в ткань мозга и их взаимодействию с другими клеточными элементами. В некоторых областях мозга, таких как срединное возвышение гипоталямуса, медиальная преоптичесая область, область четвертого желудочка мозга, астроцитарная оболочка развита сравнительно слабо. В этих регионах возможно проникновение водо-растворимых и даже заряженных молекул токсикантов в ЦНС, но также в ограниченном количестве.
Наконец последней структурой, вносящей вклад в формирование ГЭБ, является базальная мембрана, залегающая между эндотелиальными клетками капилляров и отростками астроцитов. Эта мембрана имеет упорядоченную фибриллярную макропротеидную структуру, обеспечивающую избирательное проникновение в мозг ряда важных для обеспечения его жизнедеятельности молекул (кислород, глюкоза и др.).
Аналогичный барьер окружает периферический отдел нервной системы (гематоневральный барьер). Также как и в ЦНС здесь имеются структуры с повышенной проницаемостью для токсикантов. К числу таких структур относятся корешки дорзальных ганглиев и вегетативные (автономные) ганглии.
Особенностью капиллярного русла мозга является наличие хориоидального сплетения. Это сплетение образуется капиллярами и клетками однослойного кубического эпителия, выстилающего полости желудочков мозга. Хориоидальное сплетение - место образование ликвора, жидкости, заполняющей желудочки мозга. Переход веществ из крови в ликвор определяется проницаемостью стенки капилляра и клеточной мембраны эпителия сплетения (гематоликворный барьер) и в целом затруднен для водо-растворимых и заряженных молекул. В свою очередь обмен веществ между ликвором и тканью мозга ограничивается лишь тонким слоем хорошо проницаемой эпендимы. При объяснении закономерностей распределения веществ в мозге допускают, что жидкость межклеточного пространства и ликвор желудочков мозга представляют собой единое целое. В этой связи концентрация веществ в ликворе принимается равной концентрации в межклеточном пространстве. Это допущение в значительной степени справедливо для водо-растворимых веществ и в меньшей степени - для жирорастворимых. Многие вещества, для которых гематоэнцефалический и гематоликворный барьеры не проницаемы, оказывают действие на ЦНС при их введении в желудочки мозга.
5.1.1. Некоторые свойства гематоэнцефалического и гематоликворного барьеров
Проницаемость ГЭБ для различных веществ оценивают путем их введения в кровь, с последующим определением в динамике концентрации в плазме, ликворе и гомогенате мозга.
Свойства веществ, влияющие на их способность проникать в мозг, по сути, идентичны свойствам, регулирующим проникновение соединений через клеточные мембраны: жирорастворимые соединения легко проникают в мозг, водо-растворимые - плохо; слабые кислоты и основания диффундируют через ГЭБ и ликворный барьер только в неионизированной форме; неионизированные молекулы веществ проникают через барьеры тем лучше, чем выше их коэффициент распределения в системе масло/вода; диффундировать через барьеры может лишь фракция вещества, не связанная с белками плазмы крови. В соответствии с изложенным, жирорастворимые неэлектролиты, например хлорированные углеводороды, спирты, ароматические углеводороды и др., легко проникают через ГЭБ. Напротив, чужеродные органические электролиты, например азотсодержащие основания (алкалоиды, миорелаксанты и т.д.) не проникают в ЦНС.
Необходимые мозгу вещества: субстраты обменных процессов, биорегуляторы (аминокислоты, глюкоза, нуклеотиды и др.), переносятся через ГЭБ с помощью специальных механизмов активного транспорта и проникают в ЦНС не зависимо от химических и физико-химических свойств. Синтетические аналоги этих веществ, при поступлении в кровь, могут либо проникать в ткань мозга с помощью имеющихся механизмов активного транспорта, либо блокировать проникновение в ЦНС естественных метаболитов, конкурируя с ними за механизмы транспорта. И то и другое может стать причиной формирования токсического процесса. Примером таких веществ является ![]() -метил-m-тирозин. Эта аминокислота активно переносится из плазмы крови в мозг. Здесь путем последовательного декарбоксилирования и гидроксилирования образуется молекула вещества (метараминол), провоцирующего выброс норадреналина из пресинаптических нервных окончаний с развитием соответствующих эффектов. При внутривенном введении метараминола экспериментальным животным центральные эффекты не развиваются, так как вещество, не будучи аминокислотой, не проникает через ГЭБ.
-метил-m-тирозин. Эта аминокислота активно переносится из плазмы крови в мозг. Здесь путем последовательного декарбоксилирования и гидроксилирования образуется молекула вещества (метараминол), провоцирующего выброс норадреналина из пресинаптических нервных окончаний с развитием соответствующих эффектов. При внутривенном введении метараминола экспериментальным животным центральные эффекты не развиваются, так как вещество, не будучи аминокислотой, не проникает через ГЭБ.
Проницаемость ГЭБ в значительной степени изменяется с возрастом и при различных патологических состояниях (воспалительный процесс, ацидоз). У плода и новорожденных барьер проницаем для токсикантов, не проникающих в мозг взрослого (например ионы свинца при остром отравлении солями металла). При менингите в мозг проникают антибиотики, не проходящие через ГЭБ здорового. В условиях эксперимента проницаемость гематоэнцефалического барьера можно усилить, вводя в кровь гипертонический раствор арабинозы или другие соединения (алкоголь, мочевину, нортриптилин и т.д.).
Вещества, для которых ГЭБ не проницаем, при введении в ликворное пространство (желудочки мозга) проникают в мозговую ткань. Ацетилхолин, адреналин, гистамин, амфетамин, тубокурарин и т.д. при этом способе введения быстро оказывают воздействие на ЦНС. Проникновение веществ из ликвора в мозг осуществляется с ликворным током, противоположным по направлению току жидкости в венозные синусы, формируемые твердой оболочкой мозга.
6. Гематоофтальмический барьер
На пути веществ из крови во внутриглазное пространство (и в обратном направлении) лежат барьеры двух типов.
Первый регулирует обмен веществ между кровью и внутриглазной жидкостью (камерами глаза). Главную роль здесь играет цилиарное тело, продуцирующее внутриглазную жидкость. Внутриглазная жидкость устремляется из задней камеры глаза в переднюю и покидает глаз через Шлемов канал. Переход веществ из крови в камеры глаза есть процесс простой диффузии через двухслойный эпителий цилиарного тела и, следовательно, определяется общими свойствами молекул, влияющими на проникновение соединений через биологические барьеры (см. выше). Также путем диффузии осуществляется распределение вещества между камерами глаза, стекловидным телом и другими структурными элементами глаза.
Вторым является гематоретинальный барьер, оделяющий кровь от сетчатки глаза. Гематоретинальный барьер по свойствам близок гематоликворному. Закономерности прохождения через него ксенобиотиков носит общий характер. Лишь небольшое количество веществ (главным образом питательные вещества) активно транспортируются из крови в сетчатку не зависимо от их физико-химических свойств.
7. Проникновение ксенобиотиков в печень
Печень - важнейший орган, принимающий участие в обмене веществ. Кровь, оттекающая от кишечника и содержащая вещества, поступившие в организм, направляются по системе портальной вены, прежде всего, в печень. Бесчисленное количество необходимых для организма и чужеродных соединений попадают в печень и подвергаются здесь метаболическим превращениям. Печень является органом выделения. В её секрет - желчь, выделяемый в просвет кишки, переходят многие вещества. Механизмы проникновения веществ из крови в печень и факторы, влияющие на этот процесс, имеют ряд особенностей.
7.1. Сосудистое русло
Орган снабжается кровью из двух источников. Система портальной вены приносит в печень венозную кровь, оттекающую от кишечника. Аортальная кровь поступает через печеночную артерию. В этой связи, ксенобиотики, проникающие в организм через желудочно-кишечный тракт, привносятся в орган с портальной кровью, а проникающие через кожу и легкие - по системе артериальных сосудов. Из общего объёма сердечного выброса крови, четверть (25%) поступает в печень по системе печеночной артерии, а 75% - по системе портальной вены (со сниженным содержанием кислорода).
Печеночная артерия, портальная вена и желчевыводящий проток образуют тесно связанный пучок, называемый портальной триадой. Кровь, поступающая по кровеносным сосудам, собирается в печеночные синусоиды, а затем в терминальную печеночную вену, располагающуюся в центре печеночной дольки. По печеночной вене, оттекающая от органа кровь, поступает в общий кровоток.
Именно через стенки синусоидов ксенобиотики проникают из крови в гепатоциты. Эндотелиальные клетки синусоидов имеют ядро и хорошо развитую цитоплазму. Между контактирующими клетками, как правило, имеются большие промежутки, размером 0,1 - 1,0 мкм. Это позволяет даже макромолекулам практически беспрепятственно проникать из кровеносного русла в ткань печени. В стенках печеночных капилляров залегают Купферовские звездчатые клетки. Они участвуют в захвате макромолекул и корпускулярных образований, проникших в печень, путем их пино- и фагоцитоза. Частично гепатоциты сами формируют стенку синусоида.
Между фенестрированным эндотелием синусоида и мембраной гепатоцита имеется пространство, шириной от 60 нм до 0,5 мкм (перекапиллярное пространство Диссе), куда свободно проникает плазма крови, с циркулирующими в ней веществами. Базальная поверхность гепатоцитов имеет множественные выросты, направленные в сторону этого пространства, увеличивающие площадь контакта между клетками и плазмой. Этим обеспечивается возможность усиленной абсорбции веществ из крови. Таким образом, особенность морфологии гистогематического барьера в печени состоит в том, что он представлен только клеточной мембраной гепатоцита. Кроме того, в печени выявлены многочисленные механизмы активного транспорта веществ через биологические мембраны.
7.2. Активный транспорт
Помимо жизненно необходимых веществ, печень активно захватывает многие чужеродные соединения. Прежде всего к их числу относятся различные органические кислоты и некоторые основания, выделяющиеся затем в желчь в свободной либо конъюгированной форме. Их перемещение из крови в орган и из органа в желчь порой осуществляется против градиента концентрации. Так, содержание прокаинамида в желчи может быть в 80 раз выше, чем в плазме крови. Транспортные системы, обеспечивающие движение ксенобиотиков из крови в печень, как правило, характеризуются способностью к насыщению, угнетаются веществами, блокирующими обмен веществ, и субстратами-антагонистами. Захват прокаинамида из крови и выделение в желчь блокируется молекулами других веществ - органических оснований. Органические кислоты, например бромсульфолеин, не влияют на процесс. Таким образом, транспортные системы переноса через печень органических кислот и оснований различны.
7.3. Мембранная диффузия
Как уже указывалось, функции гистогематического барьера в печени выполняют клеточные мембраны гепатоцитов. Мембрана печеночных клеток отличается высокой порозностью (в сравнении с другими клетками) и этим также определяются некоторые особенности поступления веществ из крови в печень. Хотя многие макромолекулы, легко преодолевающие эндотелиальный барьер печеночных синусоидов, и задерживаются в межклеточном пространстве, водо-растворимые молекулы с небольшой молекулярной массой легко проникают через клеточную мембрану гепатоцита. Так, водо-растворимые неэлектролиты манитол и сорбитол с большой скоростью переходят в клетки печени при их введении в кровь. Многие не растворимые в липидах вещества, такие как сахароза, инулин, декстран хорошо переносятся из крови в желчь.
Проницаемость биологического барьера для ксенобиотика может быть рассчитана по формуле:
KP = - 1/t ln [ 1 - (Ct/Cmax)] , где
KP - константа проницаемости барьера;
Ct и Cmax - концентрации веществ в ткани в момент времени t (мин) и максимальная концентрация, достижимая при оптимальных условиях эксперимента.
Если графически изобразить зависимость значений KP от коэффициента распределения веществ в системе гептан/вода, можно оценить влияние такого их свойства, как жиро-растворимость, на способность преодолевать данный биологический барьер. На рисунке 2 представлены рассматриваемые зависимости для печеночного и ликворного барьеров.
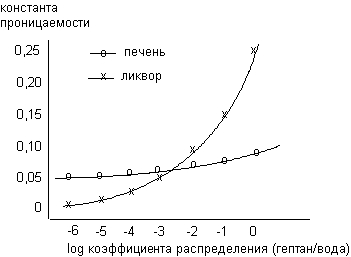
Рисунок 2. Зависимость между значениями коэффициентов распределения веществ в системе гептан/вода и их проницаемостью через гематоликворный и печеночный барьеры у кролика (H. Kurz, 1964).
Как видно из данных, представленных на рисунке, свойства гематоликворного и печеночного барьеров различны. Основная особенность печеночного барьера - отсутствие большого отличия в способности водо- и жирорастворимых веществ преодолевать его. Это связано с высокой порозностью клеточной мембраны гепатоцитов.
7.4. Фагоцитоз
Агломераты макромолекул, микрочастицы веществ, попавшие (или образовавшиеся) в кровь могут захватываться путем фагоцитоза Купферовскими звездчатыми клетками синусоидов печени. К фагоцитозу способны также эндотелиальные и паренхиматозные клетки печени. Захват частиц и макромолекул - энергозависимый процесс, угнетаемый ингибиторами процесса окислительного фосфорилирования, в частности, цианидами. Однако захват печенью крупных частиц ксенобиотиков, циркулирующих в крови, не всегда является следствием фагоцитоза. Так, в отношении агломератов полианионов (например, полифосфатов) печень ведет себя, как ионообменная колонка, адсорбируя их на поверхности гепатоцитов.
8. Поступление ксенобиотиков в экзокринные железы
Распределение веществ между кровью и железами изучено достаточно хорошо. Методически это выполняется в опытах in vivo или на изолированных органах. В процессе исследования одновременно изучают скорость исчезновения вещества из плазмы крови (перфузионной жидкости) и концентрацию его в секрете железы, например молоке, слюне, поте. Для целого ряда ксенобиотиков существует прямая корреляция между содержанием их в крови и секрете желез.
Переход токсикантов из крови в клетки желез определяется уже рассматривавшимися ранее общими характеристиками: величиной коэффициента распределения в системе жир/вода, величиной рКа, размерами молекул и т.д. Это связано с тем, что в основе перехода ксенобиотиков в клетки желез лежит процесс простой диффузии через биологические липидные пористые мембраны.
При анализе процесса распределения веществ необходимо учитывать, что секрет различных желез характеризуется неодинаковым содержанием воды и липидов (в слюне и поте преобладает вода, в молоке - большое содержание липидов). рН секрета желез не идентичен рН плазмы крови (рН слюны и молока ниже рН крови) и т.д. Слабые основания легче переходят в молоко, чем слабые кислоты. Так, для основных веществ со значением рКа равным 8,8 соотношение содержания молоко/кровь составляет около 7,0, а для кислотных веществ (рКа около 2,7) - только 0,2. В этой связи такие вещества, как никотин, морфин (и другие наркотические аналгетики), феназепам (и другие седативные средства), антигистаминные препараты - легко попадают в молоко кормящих матерей. Соотношение содержания молоко/кровь для этанола (незаряженной молекулы, растворимой и в неполярных растворителях и воде) равно 1,0.
9. Проникновение ксенобиотиков через плаценту
Если химическое вещество поступает в организм беременной женщины, оно может оказаться опасным не только для будущей матери, но и для плода, а иногда и исключительно для плода. Такая опасность обусловлена способностью многих чужеродных соединений проходить через плацентарный барьер. Особую опасность, в этой связи, представляют лекарственные препараты, вредные привычки (курение табака, прием алкоголя и т.д.), профессиональные вредности.
9.1. Плацентарный барьер
Плацента человека состоит из тканей матери и плода. Кровеносные сосуды матери впадают в межворсинчатое пространство, в которое проникают выросты хориона. В последних, в рыхлой ткани, находятся сосуды плода. На поверхности, омываемой материнской кровью, имеется синцитиальная ткань, так называемая трофобластная оболочка. Обмен веществом между кровью матери и плода осуществляется, таким образом, через следующие структуры: трофобластная оболочка, рыхлая ткань стромы выростов хориона, эндотелий капилляров хориона. В процессе развития плода толщина этих слоев не одинакова и в конце периода беременности составляет лишь несколько микрон. Площадь контакта между поверхностью хориоидных выростов и кровью матери также не постоянна и в предродовом периоде составляет около 14 м2. В ранних периодах беременности толщина барьера существенно больше, а площадь поверхности - меньше. В этой связи и проницаемость плацентарного барьера для ксенобиотиков в различные сроки вынашивания плода не одинакова. В целом у человека, она постоянно увеличивается до 8 месяца беременности, а затем опять снижается. Последствия для плода проникновения ксенобиотиков через плаценту определяется соотношением мощности потока токсиканта через плацентарный барьер с одной стороны, размерами развивающегося плода и состоянием делящихся и дифференцирующихся клеток его тканей, с другой.
9.2. Характеристика проникновения токсикантов через плаценту и распределение их в тканях плода
Большинство чужеродных веществ преодолевает плацентарный барьер путем простой диффузии. Для некоторых субстратов, биорегуляторов и жизненно-необходимых веществ могут существовать механизмы активного транспорта через плаценту, однако это окончательно не доказано. В пользу наличия механизмов активного транспорта говорит в частности тот факт, что в тканях плода содержание не синтезируемого организмом витамина В12 в 100 раз выше, чем в организме матери.
Особенностью плацентарного барьера является его способность пропускать некоторые высокомолекулярные вещества, некоторые белки и даже материнские антитела. Так, в опытах не крысах показано, что меченный 131J ![]() -глобулин может проходить из крови матери через плаценту в кровь плода. Более того, меченные радионуклидами эритроциты могут попасть в кровь плода, а затем выйти в кровеносное русло матери. Такое трансплацентарное движение высокомолекулярных соединений и форменных элементов крови возможно осуществляется с помощью механизма активного трансцитоза (цитопемзиса) либо через крупные поры в барьерной структуре. В целом проникновение веществ через плаценту подчиняется общим закономерностям, регулирующим движение веществ через полупроницаемую биологическую мембрану (см. выше). В таблице 9 представлен перечень веществ достаточно легко проникающих через плаценту в организм плода.
-глобулин может проходить из крови матери через плаценту в кровь плода. Более того, меченные радионуклидами эритроциты могут попасть в кровь плода, а затем выйти в кровеносное русло матери. Такое трансплацентарное движение высокомолекулярных соединений и форменных элементов крови возможно осуществляется с помощью механизма активного трансцитоза (цитопемзиса) либо через крупные поры в барьерной структуре. В целом проникновение веществ через плаценту подчиняется общим закономерностям, регулирующим движение веществ через полупроницаемую биологическую мембрану (см. выше). В таблице 9 представлен перечень веществ достаточно легко проникающих через плаценту в организм плода.
Таблица 9. Примеры веществ, проникающих в кровь плода через плацентарный барьер
Группа веществ |
Представители |
1.Наркотические средства |
Эфир, хлороформ, циклопропан, закись азота, трибромэтанол, трихлорэтилен, барбитураты, тиобарбитураты, уретан |
2.Снотворные (седативные) |
Барбитураты, хлоралгидрат, талидомид, этанол и другие спирты, бром |
3.Аналгетики |
Морфин и его аналоги |
4.Антипиретики |
Салицилаты, фенацетин, хинин |
5.Гормоны |
Эстроген, гестаген, андроген, кортикостероиды, анаболические стероиды, инсулин |
6.Химеотерапевтические средства |
Пенициллин, сульфониламиды, стрептомицин, эритромицин, ПАСК |
7.Прочиче |
Иприты, триметиленмеламин, аминоптерин, свинец, мышьяк, тиоурацил, иод и т.д. |
После прохождения барьера вещества оказываются в крови плода. Отсюда, в соответствии с общими закономерностями, они распределяются в его органах и тканях. Между взрослым организмом и плодом существует огромная разница в строении и свойствах тканей. Эти особенности лежат в основе иной реакции плода на многие токсиканты (см. ниже).
10. Депонирование
Под депонированием понимают особый вид распределения ксенобиотиков в организме, проявляющийся накоплением, а затем относительным постоянством их содержания в определенном органе или ткани, в течение нескольких суток - многих лет.
Депонирование имеет три основные причины: 1. Активный захват клетками ксенобиотика с последующим его удержанием; 2. Высокое химическое сродство вещества к определенным биомолекулам; 3. Значительная растворимость ксенобиотика в липидах.
Количественные характеристики процесса депонирования существенно зависят от условий, в которых они изучаются и потому носят достаточно относительный (больше/меньше) характер.
10.1. Депонирование вследствие химического сродства и растворимости в липидах
Различные токсиканты могут образовывать с биологическими молекулами ковалентные связи и таким образом накапливаться в тканях. Типичными примерами являются алкилирующие агенты тип ипритов, взаимодействующие с нуклеиновыми кислотами, многие металлы, образующие ковалентные связи с белками и другими лигандами и т.д. Мышьяк вследствие высокого сродства к кератину депонируется в ногтях и волосах. Свинец депонируется в костной ткани. Чрезмерное поступление железа в организм приводит к развитию гемосидероза, который может сохраняться на протяжение всей жизни.
Другой механизм депонирования - накопление липофильных веществ в жировой ткани. Таким образом, в организме в течение многих лет сохраняются полигалогенированные ароматические углеводороды (ПАУ), некоторые хлорорганические инсектициды (ДДТ и т.д.).
Существуют возможности влиять на процесс депонирования путем:
- прекращения поступления вещества в организм;
- усиления механизмов естественного выведения вещества. Так, кальций и свинец распределяются, депонируются и метаболизируют практически идентично. Поэтому фиксированный в костях свинец может быть мобилизован при понижении содержания кальция в крови. Усиление вентиляции легких при ингаляции карбогена усиливает выделение летучих веществ (эфиры и т.д.) и высвобождение их из жировой ткани;
- введения веществ, взаимодействующих с ксенобиотиком. Вещества, имеющие высокое сродство к депонированному агенту, могут вступить с ними во взаимодействие и вывести из места депонирования. Таким способом можно удалить из организма некоторые тяжелые металлы, например свинец, с помощью комплексообразователей (ЭДТА, унитиола и т.д.).
10.2. Депонирование вследствие активного захвата ксенобиотика
Если вещество поступает в клетки против градиента концентрации, то оно может накапливаться в них. Это имеет место в определенных органах и тканях в отношении лишь очень ограниченного количества веществ. Механизм депонирования выявлен для некоторых аналогов биогенных аминов (5-ОН-триптамина, хлорфенилаланина и др.), белковых токсинов (холерного, дифтирийного, столбнячного, ботулотоксина), йода и др.
|