С. А. КУЦЕНКО
ОСНОВЫ ТОКСИКОЛОГИИ,
Санкт-Петербург,
2002
|
ГЛАВА 3.3. ОЦЕНКА РИСКА ДЕЙСТВИЯ ТОКСИКАНТА
Человек подвержен действию огромного количества вредных химикатов, следовательно, всегда имеется риск возможного вреда, причиняемого ими. Очень часто общество нуждаются в разумных, обоснованных предложениях о путях снижения риска. Такие предложения могут быть сделаны только на основе информации о вероятности и характере вредного действия. Это и послужило поводом для разработки методологии оценки риска, которая предназначена для его идентификации, характеристики и измерения.
1. Исторические аспекты
В 50-х годах, вследствие установления факта канцерогенности ионизирующих излучений, появилась необходимость оценки риска развития новообразований при облучении. Разработка методики оценки риска канцерогенеза, обусловленного действием химических веществ, была начата в 60-х годах, как реакция на возрастающее загрязнение окружающей среды. В 1961 году Управление по Пищевым и Лекарственным Веществам США (FDA) предложило первую редакцию методики. В дальнейшем было разработано и принято несколько реализующих документов. В настоящее время оценка риска - важный инструмент принятия решений на административном уровне во многих странах мира.
2. Что такое оценка риска?
Риск - это вероятность ущерба здоровью, или более точно, вероятность травмы, заболевания или смерти при определенных условиях. Другими словами, риск это потенциальная возможность реализации нежелательных последствий некоего события. Оценка риска строится на анализе конкретной ситуации и состоит в определении вероятности вредного действия изучаемого фактора. Частным случаем является количественная оценка вероятности ущерба здоровью человека, связанного с действием определенных агентов, например, химических веществ, находящихся в окружающей среде или на рабочем месте.
Базовой информацией для проведения исследования является токсикологическая характеристика вещества, риск от воздействия которого предполагается оценить. Изучение токсикологической характеристики веществ - сложный процесс, включающий целый спектр технических приемов (таблица 1).
Таблица 1. Токсикологическая характеристика вещества, привлекаемая для оценки риска его воздействия
1. Химические и физические свойства 2. Судьба в окружающей среде и способы воздействия на биологические системы (организм) А. Источники Б. Стойкость на местности В. Пути превращения в окружающей среде Г. Возможности биоаккумуляция и биомагнификации в организмах живых существ: -токсикокинетические характеристики -особенности метаболизма 3. Тесты in vivo А. Оценка острой токсичности: -величины ЛД50 и ЛК50 Б. Подострое воздействие: -токсичность при 90-суточном скармливании токсиканта -токсичность при 30 - 90 суточном ингаляционном и/или чрезкожном воздействии В. Хроническое действие: - токсичность при пожизненном введении Г. Специальные виды токсичности: -раздражающее действие -способность сенситизации кожных покровов -тератогенность -канцерогенность -репродуктивная токсичность Д. Избирательная токсичность: -нейротоксичность -гепатотоксичность -пульмонотоксичность -нефротоксичность и т.д. 4. Тесты in vitro -мутагенность (исследования на прокариотах, эукариотах) -способность вызывать хромосомные аберрации -канцерогенность 6. Натурные исследования -эпидемиологические исследования -оценка экологического ущерба |
Как указывалось ранее, токсические процессы можно отнести к одной из следующих групп:
- формирующиеся по пороговому принципу;
- формирующиеся по беспороговому принципу.
В первом случае причинно-следственная связь между фактом действия вещества и развитием процесса носит безусловный характер. Зависимость "доза-эффект" прослеживается на уровне каждого, подвергающегося воздействию организма, при этом, чем больше доза, тем выраженнее реакция. Вместе с тем при действии веществ в дозах ниже определенных уровней (порогов) токсический процесс не развивается вовсе (интоксикации, транзиторные токсические реакции).
Во втором случае причинно-следственные связи между фактом действия вещества и развитием процесса носят вероятностный характер. Зависимость "доза-эффект" прослеживается только на уровне популяции: чем больше доза, тем у большей части особей испытуемой популяции регистрируется эффект. При этом вероятность формирования токсического процесса сохраняется при действии на биосистему даже одной молекулы токсиканта (беспороговый эффект), хотя у отдельных организмов эффект может не развиться даже при очень интенсивных (смертельных) воздействиях (мутагенез, канцерогенез, тератогенез).
В этой связи и количественные характеристики риска определяются в соответствии с двумя операционными схемами.
Токсиканты, способные провоцировать токсические процессы, развивающиеся только по пороговому принципу, могут быть охарактеризованы с помощью критерия "фактор безопасности" (индекс опасности). Оценить риск контакта с таким веществом, означает, по сути, - определить порог его токсического (или безопасного) действия, выразив его через величины предельно допустимой дозы (ПДД) или предельно допустимой концентрации (ПДК). За рубежом для этой цели используют такие показатели как: уровень максимального загрязнения (УМЗ), допустимый суточный прием (ДСП), рекомендуемая доза (РД) (соответственно: Maximum Contaminant Level, Acceptable Daily Intake, Reference Dose). Эти характеристики определяются по специальным методикам, в основе которых лежит установление зависимости "доза-эффект", и в дальнейшем утверждаются законодательно (см. выше). В любом случае указанные величины характеризуют количество токсиканта (в миллиграммах на килограмм массы тела или миллиграммах на единицу объема объекта, среды), контакт с которым не приводит к появлению каких бы то ни было неблагоприятных последствий при хроническом действии в популяции, включая группы чувствительных лиц.
В ходе оценки риска, измеряют действующие дозы токсикантов, находящихся в окружающей среде (экспозиционные дозы - ЭД), после чего их сравнивают с величинами безопасных доз и концентраций и на этом основании судят о степени риска воздействия.
Часто для оценки риска используют еще одну величину - хронического ежедневного приема (ХЕП). ХЕП характеризует воздействия, при контакте с токсикантом на протяжение всей жизни. Единицей измерения ХЕП является величина массы токсиканта приходящаяся на величину массы тела в единицу времени (мг/кг/сут).
Для химических веществ с определенным порогом токсического действия оценка риска сводится к определению отношения ЭД к РД и т.д. Эти соотношения и называются "индекс опасности".
Порядок расчета индекса опасности, связанной с действием вещества, осуществляется следующим образом:
Индекс опасности = ЭД/РД,
где: ЭД - экспозиционная доза
РД - рекомендуемая доза
(при этом ЭД и РД должны выражаться в одинаковых величинах, применительно к одинаковым временным условиям воздействия - острому, подострому, хроническому).
Если индекс опасности выше 1, имеется риск связанный с действием токсиканта.
Риск развития эффектов, развивающихся по беспороговому принципу, должен быть охарактеризован другим способом. В частности, следует установить действующую дозу токсиканта, при которой частота возникновения вызываемого эффекта (канцерогенез) в экспонируемой популяции, находится на "допустимом" (выбранном субъективно) уровне. Эта доза рассчитывается путем математического моделирования. Обычно, в качестве "допустимого" принимают воздействие, при котором в популяции количество, например, смертей от новообразований увеличится не более чем на 1 случай на миллион (1х10-6), при условии контакта людей с токсикантом в течение всей жизни. Однако в зависимости от обстоятельств (особенности региона и т.д.) этот уровень может колебаться в диапазоне 1х10-3 - 1х10-6. Такой подход обозначается, как методология оценки риска беспорогового действия, а определенная таким образом доза токсиканта в зарубежной литературе получила название виртуальная безопасная доза (virtual safe dose - ВБД). В России, в соответствии с "Методическими рекомендациями по экспериментальному обоснованию гигиенических регламентов химических канцерогенных веществ" (1985), в основе регламентации канцерогенов лежит определение их ПДК.
За рубежом, для веществ, вызывающих беспороговые эффекты (канцерогенез и др.), риск выражают как вероятностную величину. В частности для оценки риска канцерогенеза используют "фактор канцерогенной активности вещества". Эта величина определяется с помощью расчетных методик на основе экспериментального материала и представляет собой угол наклона зависимости между величинами вероятности развития новообразования и действующей дозы токсиканта (q). Результат умножения величины ХЕП (см. выше) на q дает безразмерную величину риска развития новообразования. Если эта величина превышает установленный уровень, воздействие признается опасным.
Порядок расчета опасности воздействия веществ, связанной с развитием беспороговых эффектов, осуществляется следующим образом:
Риск = 1 - exp(-ХЕП) q,
где:
Риск - вероятность развития конкретной опухоли при анализируемой величине ХЭП;
exp - экспоненциал;
ХЕП - величина хронического ежедневного приема, усредненная на 70 лет жизни (мг/кг.сут);
q - фактор канцерогенной активности вещества.
Методика оценки опасности может быть упрощена, при условии, что безопасные концентрации вещества уже известны. В этом случае величину ХЕП просто сравнивают с величиной ВБД. Если ХЕП больше, это свидетельствует о превышении допустимого содержания вещества, установленного законодательством.
Целью определения риска иногда являются числовые характеристики вероятности развития определенных неблагоприятных эффектов, например фиброза легких, хронической печеночной недостаточности, новообразования, смерти и т.д.
3. Процесс оценки риска
Из-за большого разнообразия условий и свойств токсикантов не возможно создать единый сценарий, позволяющий оценивать риск всех химических веществ во всех возможных ситуациях. Существует методология поэтапного решения задачи, в соответствии с которой можно провести полный анализ различных случаев. Она включает четыре элемента:
1. Идентификация опасности;
2. Оценка воздействия;
3. Оценка токсичности;
4. Характеристика риска.
Каждый из этих элементов имеет непосредственное отношение к важнейшим характеристикам, определяющим риск от воздействия токсикантов:
- наличия опасных токсикантов в окружающей среде;
- судьбы токсиканта в окружающей среде;
- способа воздействия на организм;
- токсикологических свойств вещества;
- характеристики популяции, на которую действует токсикант;
- вероятности ожидаемого риска для здоровья.
Общая схема алгоритма оценки риска представлена на рисунке 1.
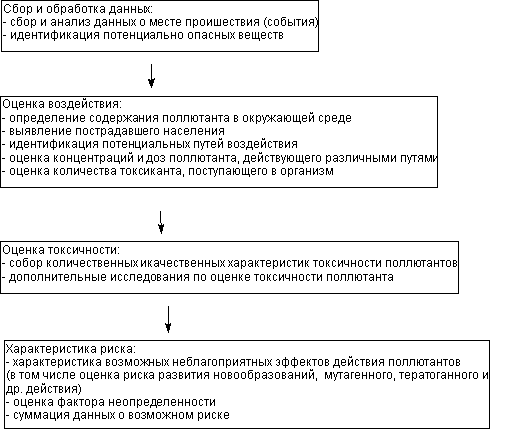
Рисунок 1. Алгоритм оценки риска действия токсиканта
3.1. Идентификация опасности
В ходе этого этапа определяют, какие вещества оказывают воздействие на организм, пути их поступления в окружающую среду, обладают ли они потенциальной способностью вызывать неблагоприятные эффекты в организме (в том числе канцерогенное, мутагенное и иные), изменять среду обитания.
Все доступные данные по токсикантам собираются, систематизируются и используются для оценки токсического потенциала веществ. Если в среде присутствует большое количество токсикантов возможно выбрать для анализа некое вещество-индикатор загрязненности.
3.2. Оценка воздействия
Оценка воздействия - этап, на котором количественно определяют дозу токсиканта, действующую на организм в конкретной анализируемой ситуации (экспозиционная доза). При этом изучают данные определения содержания вещества в воздухе, воде, почве, пищевых продуктах, элементах биоты. При оценке воздействия определяют популяцию лиц, подвергающихся агрессии, а также частоту, продолжительность действия токсиканта, способ воздействия на организм.
В ходе работы желательно выявить часть населения с повышенной чувствительностью к ксенобиотику. Необходимо тщательно проанализировать пути поступления токсиканта в организм.
В результате получают данные, позволяющие оценить количество вещества, поступающего в организм в течение длительного и пожизненного воздействия:
I = C R D / W T , где:
I - количество вещества, поступающего в организм (мг/кг);
C - концентрация токсиканта в среде (средняя концентрация за период воздействия: мг/л; мг/м3 и т.д.);
R - количество зараженного элемента внешней среды, поступающего в организм в сутки (л/день, г/день);
D - кратность и продолжительность воздействия;
W - средний вес тела человека за весь период воздействия;
Т - время, в течение которого получены усредненные данные.
3.3. Оценка токсичности
Третий этап исследования состоит в установлении зависимости "доза-эффект" для изучаемых веществ. Конечная цель этого этапа работы заключается в установлении уровня доз, при которых появляются неблагоприятные эффекты от действия токсиканта на организм. Если эти характеристики уже найдены, но не утверждены законодательно, исследования могут быть продолжены в требуемом объеме. Если данных нет, можно попытаться получить ориентировочные значения токсичности веществ, прибегая даже к расчетным методам. Наконец, рекомендуемая доза может быть определена путем деления установленной в иных исследованиях пороговой дозы на фактор безопасности.
Фактор безопасности является своеобразным допущением, учитывающим неполноту или недостаточность наших знаний о токсичности вещества. Фактор безопасности иногда устанавливается на основе данных, доступных для анализа (таблица 2).
Таблица 2. Величины фактора безопасности, используемые при оценке риска и установлении допустимого уровня воздействия токсиканта
Фактор безопасности |
Критерии выбора величины |
10 |
Экстраполяция доз, полученных в результате анализа эффектов, развивающихся при длительном воздействии токсиканта на ограниченную группу лиц; позволяет обезопасить часть населения, с повышенной чувствительностью к химическим веществам |
10 |
Дополнительное десятикратное снижение допустимого уровня действующих доз, если осуществляется экстраполяция данных, полученных в хроническом опыте на экспериментальных животных |
10 |
Дополнительное снижение величины, если экстраполируемые данные получены в остром и подостром опыте на экспериментальных животных |
1 - 10 |
Суждение научной общественности может быть использовано для дополнительного снижения допустимого уровня действующих доз с целью коррекции неопределенности, обусловленной другими факторами, не указанными в предыдущих графах |
3.4. Характеристика риска
Характеристика риска - конечный этап работы. На этом этапе обобщается вся информация, использованная и полученная на предыдущих этапах. Итоговый документ по оценке риска составляется в зависимости от цели исследования. Рассчитываются, в случае возможности, количественные характеристики риска, в частности индекс опасности. Часто бывает необходимо указать на неопределенный характер отдельных параметров и т.д.
Если вещество проявляет свойства канцерогена в документе должно быть представлено значение риска развития новообразований в конкретных условиях, т.е. указано, какое количество дополнительных случаев новообразований возникнет в популяции, на которую действует (или действовал) токсикант, в сравнении с контрольной группой.
4. Недостатки методологии оценки риска
Методология оценки риска была разработана как инструмент принятия решения административными органами, на основе данных о возможном ущербе здоровью, наносимом оцениваемым фактором. Определенная надежность получаемых результатов обусловлена использованием экспертами научно обоснованных данных. Однако, поскольку значительная часть информации, необходимой для анализа, остается неоцененной и используемые модели не всегда верифицированы, достоверность результатов страдает, т.е. процесс оценки риска всегда сопряжен с некоторыми неопределенностями, связанными с неполнотой наших знаний о механизмах и характере токсического действия веществ.
Каждый этап оценки риска предполагает формирование определенных выводов при отсутствии исчерпывающей информации, необходимой для этого. В этой связи основные недостатки методологии оценки риска связаны с необходимостью принятия большого числа допущений (экстраполяции данных, моделирования ситуации и т.д.), что сказывается на точности формулируемых выводов.
Существует четыре основных источника появления неопределенности в методологии оценки риска:
- влияние свойств и особенностей окружающей среды на эффекты, вызываемые токсикантами;
- допущения в процессе установления зависимости "доза-эффект";
- допущения при определении токсикокинетических параметров ксенобиотика;
- неопределенность, обусловленная переходами от одного этапа исследования к другому.
Для правильного отношения к результатам исследования необходимо иметь представление о причинах и механизмах появления неопределенности в процессе оценки риска.
4.1. Экстраполяция данных
Экстраполяция - это процесс распространения выводов (суждений, заключений), полученных для определенных объектов в определенных условиях, на иные объекты и иные условия. Экстраполяция при оценке риска действия токсикантов, как правило, касается переноса данных, полученных на одном виде животных, на другие биологические объекты (другие виды животных, человека), установленные в условиях моделирования непрерывного воздействия - на интермитирующее, результатов, полученных для больших доз воздействия - на малые и т.д. Очевидно, что экстраполяция требует целого ряда допущений, которые и являются источниками неопределенности. Улучшение способов экстраполяции предполагает исчерпывающее знание токсикокинетических и токсикодинамических характеристик токсикантов. В настоящее время для большинства веществ такая информация просто отсутствует.
Необходимость экстраполяции диктуется объективными причинами. Так, оценка токсичности осуществляется в опытах на лабораторных животных. Вместе с тем хорошо известны видовые различия чувствительности к токсикантам (таблица 3).
Таблица 3. Сравнительная токсичность некоторых веществ для человека и экспериментальных животных (ЛД50; мг/кг - через рот)
Вещество |
Человек |
Крыса |
Мышь |
Кролик |
Собака |
Анилин |
350 |
440 |
- |
- |
- |
Амитал |
43 |
560 |
- |
575 |
- |
Борная кислота |
640 |
2660 |
3450 |
- |
- |
Кофеин |
192 |
192 |
620 |
- |
- |
Карбофуран |
11 |
5 |
2 |
- |
- |
Линдан |
840 |
125 |
- |
130 |
120 |
Аминопирин |
- |
1380 |
1850 |
160 |
150 |
(А. Rowan, 1983)
Иногда считают, что человек - наиболее восприимчивый вид. В частности из этого представления исходят при изучении канцерогенной активности ксенобиотиков. Однако это не так. Изучая и используя на практике явление избирательной токсичности, удалось создать огромное количество препаратов, малотоксичных для людей и высокотоксичных для представителей других видов (антибиотики, противопаразитарные средства, пестициды и т.д.). Поэтому в тех случаях, когда при определении риска основываются на рассматриваемой посылке, может возникнуть существенная переоценка степени риска для человека.
Для достоверного выявления "слабых" токсических эффектов вещества, действующего в малых дозах, порой необходимо проведение эксперимента на тысячах лабораторных животных. Ни физически, ни экономически это не осуществимо. Поэтому обычно исследование проводится с использованием высоких доз токсикантов, что позволяет получить статистически значимые результаты. Однако затем необходим этап обратной экстраполяции. Существует несколько математических моделей экстраполяции данных, полученных в опытах с высокими дозами веществ на малые, но отсутствует информация, какая из этих моделей адекватно характеризует процесс, или даже на сколько реальны они все. Эти модели хорошо (и главное практически одинаково) описывают зависимость "доза-эффект" при относительно высоких уровнях воздействия, но при слабых воздействиях, выявляются существенные различия между ними. Причем, чем к более малым дозам экстраполируются результаты, тем больше вероятность расхождений. В рамках существующего знания отсутствует возможность экспериментальной верификации этих моделей.
Неопределенности, возникающие при использовании для оценки риска данных, полученных в ходе эпидемиологических исследований, рассмотрены в соответствующем разделе книги.
4.2. Неадекватные исследования
Многие данные, полученные в эксперименте, не могут быть надежно использованы в процессе оценки риска. Так, целый ряд характеристик токсичности веществ получен в условиях, совершенно не соответствующих тем, для которых оценивается риск. Вместе с тем проявления токсического действия, как правило, существенно зависят от условий проведения эксперимента. Дозы, примененные экспериментатором для оценки токсических свойств ксенобиотика, могут существенно отличаться от тех, в которых токсикант действует на организм в реальных условиях. Естественно и последствия этого воздействия могут быть совершенно иными.
4.3. Различия в механизмах токсического действия
Особенности механизмов токсического действия веществ могут иметь решающее значение для выбора методологии оценки риска действия ксенобиотиков. Так, принято выделять две группы канцерогенов: взаимодействующие с ДНК (генотоксическое действие) и не взаимодействующие с ДНК (эпигенетическое действие). Современные теории, описывающие химический канцерогенез, выделяют три этапа развития опухоли: инициацию, промоцию, экспрессию. Инициаторы и промоторы с известными допущениями могут быть охарактеризованы соответственно как генотоксиканты и эпигенотоксиканты. Вещества, относящиеся к первой группе действуют по беспороговому принципу, в то время, как эпигенотоксиканты могут быть охарактеризованы соответствующим пороговым значением доз. Методология оценки риска для таких веществ, принципиально различна (см. выше). Однако далеко не для всех канцерогенов установлен механизм их действия. Существующая методика оценки риска действия канцерогенов не учитывает различий механизмов их действия.
4.4. Популяционные различия
Методология расчета риска имеет дело с "типичным" человеком, но хорошо известно, на сколько реальные люди отличаются от воображаемого стандарта. Определяемые значения коэффициентов риска рассчитаны на применение в популяции. Однако выраженность ответных реакций индивидов, составляющих популяцию, на токсикант, как ожидается, должна подчиняться закону нормального распределения. В этой связи установление единого индекса опасности для всей популяции приводит к "ущемлению интересов" лиц, чувствительность которых к ксенобиотику выходит за рамки "обычной" с позиции современной статистики (группа лиц с высокой чувствительностью). Таким образом, усреднение коэффициентов риска, использование наиболее вероятных значений этой величины приложимы только к популяции в целом и представляют собой значительные допущения, рождающие неопределенность, при использовании их применительно к конкретному человеку.
В последнее время в токсикологических лабораториях часто используют инбредных животных. Получаемые в этом случае результаты варьируют не в столь широких пределах, как в реальной генетически гетерогенной популяции, каковой, в частности, является популяция людей. Используя такие данные, исследователь может допустить ошибку в отношении возможного риска для тех подгрупп населения, чувствительность которых к токсиканту особенно велика.
4.5. Неопределенность при оценке воздействия
Оценка воздействия - самый слабый элемент системы оценки риска. Значения, обычно характеризующие воздействия, являются результатом редких измерений. Дозы, которые получил человек, часто устанавливаются расчетным методом. При этом их определение осуществляется с учетом усредненных характеристик массы организма (70 кг) и потребления человеком (например, 2 литра питьевой воды в сутки, 20 м3 вдыхаемого воздуха в день, 100 мг почвы, попадающей ежедневно в организм с пищей и вдыхаемым воздухом и т.д.). Такие оценки воздействия адекватно характеризуют лишь небольшую часть населения. В итоге получаются результаты существенно отличающиеся от реальных.
Уровень воздействия, частота, продолжительность, способ воздействия никогда в полной мере не являются неизменными. Источник воздействия, например зараженная среда, часто не могут быть охарактеризованы количественно. Обычно для этой цели прибегают к использованию усредненных результатов отдельных измерений, а еще чаще - расчетным методам. В существенном улучшении нуждаются методики описания поведения токсикантов в окружающей среде.
Факторы окружающей среды, такие как температура, влажность воздуха, скорость ветра, шумы, плотность населения, питание, привычки, активность и т.д. - оказывают большое влияние на особенности и выраженность действия ксенобиотиков. Эти факторы сказываются, например, на особенностях токсикокинетики веществ в организме.
Изложенные обстоятельства - важные источники неопределенности, поскольку не могут быть полностью учтены.
4.6. Неопределенность, связанная с комбинированным действием токсикантов
В реальных условиях люди не подвергаются изолированному воздействию какого либо одного химического вещества. Как правило, действуют смеси соединений самого различного состава. Естественно, в лабораторных условиях, с целью получения количественных характеристик токсичности, никогда не удастся воспроизвести все эти бесконечные смеси. А вместе с тем вопрос о том, каков эффект данной комбинации ксенобиотиков, каковы характеристики коергизма компонентов смеси (синергизм или антагонизм) является чрезвычайно важным. В настоящее время существующая методология оценки риска не позволяет решить эту проблему, основываясь на научных представлениях. Существующие методы оценки путем простого суммирования действующих доз ксенобиотиков, составляющих смесь, имеют отчетливый механистический характер.
Заключение
До настоящего времени многие ученые противятся распространению методологии оценки риска, поскольку считают его не в полной мере адекватным решаемым задачам. Причина этого в высокой степени неопределенности получаемых результатов, в основе которой - скудость наших знаний в области токсикологии огромного количества токсикантов, окружающих современного человека, общих законов науки токсикологии, несовершенство методологии определения токсичности и т.д.
Конечно хотелось бы, основываясь на строгом научном подходе, идентифицировать и устранить все источники риска для здоровья человека. Поэтому следует уделять пристальное внимание развитию методологии оценки риска, но при этом каждому должно быть понятно, что нулевой риск, в частности от действия химических веществ - недостижимая иллюзия.
|